题目内容
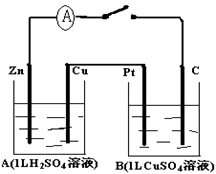
(12分)有右图装置:回答下列问题:
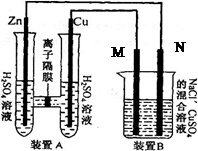
(1)装置A是_______池,B是_______池。
(2)装置A中的Zn极是_______极,
Cu极上的电极反应方程式为:__________________。
(3)装置B中是浓度均为1.0mol/L的NaCl、CuSO 混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;
混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;
(4)欲用装置B给用来给餐具镀银,N应该是 (填“银” 或“餐具”), 电镀液的主要成分是(填化学式) 。

(1)装置A是_______池,B是_______池。
(2)装置A中的Zn极是_______极,
Cu极上的电极反应方程式为:__________________。
(3)装置B中是浓度均为1.0mol/L的NaCl、CuSO
 混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;
混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;(4)欲用装置B给用来给餐具镀银,N应该是 (填“银” 或“餐具”), 电镀液的主要成分是(填化学式) 。
((1)小题每格1分,其余2分)(1)原电池; 电解池;
(2)负;Cu极上的电极反应式;H2-2e-=H2↑;
(3) 32 g; (4)餐具; AgNO 3 ;
(2)负;Cu极上的电极反应式;H2-2e-=H2↑;
(3) 32 g; (4)餐具; AgNO 3 ;
(1)根据装置图中电解材料的性质及电解质溶液可知,A是铜锌原电池,B是电解池。
(2)原电池中较活泼的金属作负极,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子生成氢气,反应式为H2-2e-=H2↑。
(3)A中Zn棒质量减少32.5g时,转移电子是32.5g÷65g/mol×2=1.0mol。N和电源的负极相连,是阴极,溶液中的铜离子放电。溶液中铜离子的物质的量是1mol/L×0.5L=0.5mol,恰好需要1mol电子,生成0.5mol铜,质量是32g。
(4)电镀时待镀金属作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电镀液,N是阴极,连接餐具,可以用硝酸银作电镀液。
(2)原电池中较活泼的金属作负极,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子生成氢气,反应式为H2-2e-=H2↑。
(3)A中Zn棒质量减少32.5g时,转移电子是32.5g÷65g/mol×2=1.0mol。N和电源的负极相连,是阴极,溶液中的铜离子放电。溶液中铜离子的物质的量是1mol/L×0.5L=0.5mol,恰好需要1mol电子,生成0.5mol铜,质量是32g。
(4)电镀时待镀金属作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电镀液,N是阴极,连接餐具,可以用硝酸银作电镀液。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
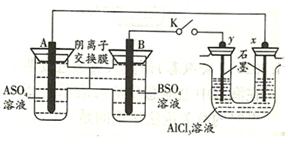
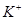 通过,该电池放电时的化学方程式为:
通过,该电池放电时的化学方程式为: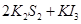 ?=
?=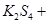 3KI。装置(Ⅱ)为电解示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是?( )
3KI。装置(Ⅱ)为电解示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是?( ) 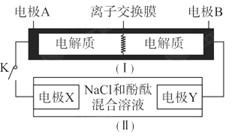
 =
=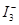
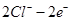 =
=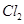 ↑
↑