题目内容
【题目】(1)常温下将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液。
①该溶液中除H2O的电离平衡外还存在的平衡体系是___。
②溶液中共有___种不同的微粒。
③这些粒子中浓度为0.01mol·L-1的是___,浓度为0.002mol·L-1的是___。
④物质的量之和为0.01mol的两种微粒是___。
(2)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
①已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1H2B溶液中c(H+)___(填“<”、“>”、“=”)0.11mol·L-1理由是___。
②0.1mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是___。
【答案】NH3·H2O![]() NH4++OH-,NH4++H2O
NH4++OH-,NH4++H2O![]() NH3·H2O+H+ 7 Cl- Na+ NH4+、NH3·H2O < H2B第一步电离产生的H+对HB-的电离起了抑制作用 c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
NH3·H2O+H+ 7 Cl- Na+ NH4+、NH3·H2O < H2B第一步电离产生的H+对HB-的电离起了抑制作用 c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
【解析】
0.01molNH4Cl和0.002molNaOH按物质的量比1:1进行反应生成一水合氨和氯化钠,反应的定量关系可知氯化铵过量,溶液中溶质为NH3H2O、NaCl、NH4Cl;由H2B在水中的电离方程式H2B=H++HB-;HB-![]() H++B2-可知,第一步完全电离、第二步部分电离。
H++B2-可知,第一步完全电离、第二步部分电离。
(1)①氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,故溶液中存在一水合氨的电离平衡,铵根离子水解平衡以及水的电离平衡:NH3·H2O![]() NH4++OH-,NH4++H2O
NH4++OH-,NH4++H2O![]() NH3·H2O+H+,H2O
NH3·H2O+H+,H2O![]() H++OH-。
H++OH-。
②溶液中溶质为NH3H2O、NaCl、NH4Cl,溶液中存在钠离子、氯离子、铵根离子、氢氧根离子、氢离子、一水合氨分子、水分子,共有7种不同的微粒。
③因为平衡体系的存在,微粒中只要钠离子、氯离子在溶液中不发生变化,这些微粒中浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+。
④物料守恒分析,0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,则溶液中存在的氮元素物质的量一定为0.01mol,铵根离子结合氢氧根离子生成一水合氨,一水合氨电离生成铵根离子和氢氧根离子,根据物料守恒可知,氮元素的存在形式为NH4+、NH3H2O,则物质的量之和为0.01mol的两种微粒是NH4+、NH3H2O。
(2)①因为0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1HB-电离出的氢离子的浓度为0.01 mol·L-1,0.1mol·L-1H2B溶液中,H2B=H++HB-电离出0.1mol·L-1氢离子和0.1mol·L-1 HB-,但H2B=H++HB-电离出的H+对HB-的电离起了抑制作用,故0.1mol·L-1H2B溶液中c(H+)<0.11mol·L-1。
②0.1mol·L-1NaHB溶液中存在HB-![]() H++B2-,故
H++B2-,故

【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
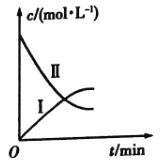
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快