题目内容
【题目】绿矾(FeSO4·7H2O)外观为半透明蓝绿色单斜结晶或颗粒,无气味。受热能分解,且在空气中易被氧化。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
(1)向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为_______。
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是__。
②洗涤操作,选用的最佳洗涤试剂是_______(填序号)。
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
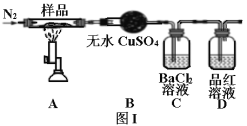
(1)加热前通入氮气的目的是_______。
(2)实验中观察到装置B现象为_______。
(3)C装置和D装置能否调换_______(填“能”或“否”)。
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是_______。
(5)该装置有个明显缺陷是_______。
III.测定绿矾样品中铁元素的含量。
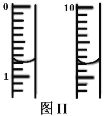
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L1 KMnO4 溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为_______(用含m、c的式子表示)。
【答案】Fe2++2HCO3=FeCO3↓+CO2↑+ H2O 防止二价铁被氧化 B 将装置内空气排尽(或隔绝空气或防止Fe2+被氧化) 白色粉末变蓝 否 取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3 没有尾气处理装置 ![]()
【解析】
Ⅰ(1)FeCl2溶液中,加入NH4HCO3,可以认为Fe2+结合HCO3-电离出来的CO32-,H+与HCO3-结合生成CO2和水;
(2)柠檬酸除了酸性还有还原性,可以起到防氧化的作用;
(3)产物易溶于水,难溶于乙醇,洗涤时,为了防止溶解损失,应该用乙醇洗涤;
Ⅱ绿矾分解,其产物中有SO2、SO3和水,
用无水硫酸铜验证水,用BaCl2溶液验证SO3,品红溶液验证SO2。
Ⅰ(1) FeCl2溶液中,加入NH4HCO3,可以认为Fe2+结合HCO3-电离出来的CO32-,H+与HCO3-结合生成CO2和水,离子方程式为Fe2++2HCO3=FeCO3↓+CO2↑+ H2O;
(2)根据表中信息,柠檬酸除了酸性还有还原性,可以起到防氧化的作用,因此另一个作用是防止二价铁被氧化;
(3)甘氨酸亚铁易溶于水,难溶于乙醇,为了防止溶解损失,可以用乙醇洗涤,答案选B;
II(1)加热前通氮气,排除装置中的空气,防止样品,加热是被氧化;
(2)产物中有水,无水硫酸铜,遇到水蒸气,变蓝色;
(3)SO3会溶于水,生成H2SO4,如果C、D装置调换位置,SO3会溶于品红溶液,不能进入C中,被检验到;
(4)检验Fe2O3,可以检验Fe3+,用KSCN溶液,方法为取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3;
(5)品红溶液只能用于检验SO2,不能吸收SO2,SO2为有毒气体,需要进行尾气出来,该装置的缺陷是没有气体处理装置;
III根据化学方程式,可知关系式5Fe2+~MnO4,消耗KMnO4溶液的体积为10.80mL-0.80mL=10.00mL,则n(KMnO4)=10.00mL×10-3×cmol·L-1=0.01cmol;n(Fe2+)=5n(KMnO4)=0.01cmol×5=0.05cmol;则铁元素的质量为0.05cmol×56g·mol-1=2.8cg,则晶体中铁元素的质量分数为![]() 。
。

 阅读快车系列答案
阅读快车系列答案