题目内容
CO是一种无色、无味且不溶于水的有毒气体,其制法有:
(1)实验室可用甲酸和浓H2SO4共热制取CO.HCOOH H2O+CO↑
H2O+CO↑
a.甲酸和浓H2SO4应怎样混合?浓H2SO4起什么作用?
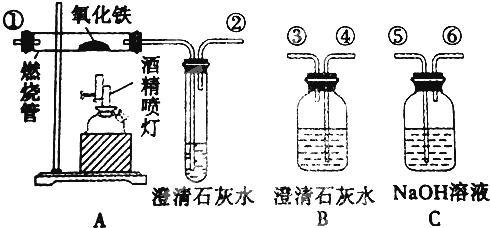
b.请据实验原理选择所需主要玻璃仪器(导管除外).
c.怎样收集CO气体?
(2)实验室还可用草酸晶体与浓H2SO4共热制取CO.H2C2O4 CO2↑+CO↑+H2O请问:怎样才能得到不含CO2的CO气体?
CO2↑+CO↑+H2O请问:怎样才能得到不含CO2的CO气体?
(3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:______.在此条件下,C和H2的还原性谁强?
解:(1)CO是一种无色、无味且不溶于水的有毒气体,实验室可用甲酸和浓H2SO4共热制取CO.HCOOH H2O+CO↑,
H2O+CO↑,
a.浓硫酸是催化剂和吸水剂,由于甲酸密度小于浓硫酸,所以混合时把浓硫酸加入甲酸中;
b.实验装置是:液体+液体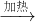 气体,需要的玻璃仪器为:分液漏斗(装甲酸)、圆底烧瓶(装浓H2SO4)、酒精灯、干燥管、集气瓶;
气体,需要的玻璃仪器为:分液漏斗(装甲酸)、圆底烧瓶(装浓H2SO4)、酒精灯、干燥管、集气瓶;
c.一氧化碳是难溶于水的比空气略轻的气体,用排水法收集;
故答案为:a、将甲酸滴入热的浓H2SO4中;脱水作用;
b、分液漏斗(装甲酸)、圆底烧瓶(装浓H2SO4)、酒精灯、干燥管、集气瓶;
c、排水集气法;
(2)草酸晶体与浓H2SO4共热制取CO.H2C2O4 CO2↑+CO↑+H2O,生成的产物为二氧化碳、一氧化碳、水蒸气,通过碱石灰或NaOH溶液,可以吸收二氧化碳和水蒸气,
CO2↑+CO↑+H2O,生成的产物为二氧化碳、一氧化碳、水蒸气,通过碱石灰或NaOH溶液,可以吸收二氧化碳和水蒸气,
故答案为:通过碱石灰或NaOH溶液;
(3)焦炭和水在高温下发生反应制取CO,其化学方程式为:C+H2O CO+H2 ;氧化还原反应的还原剂的还原性大于还原产物所以还原性C>H2,
CO+H2 ;氧化还原反应的还原剂的还原性大于还原产物所以还原性C>H2,
故答案为:C+H2O CO+H2,还原性C>H2.
CO+H2,还原性C>H2.
分析:(1)CO是一种无色、无味且不溶于水的有毒气体,实验室可用甲酸和浓H2SO4共热制取CO.HCOOH H2O+CO↑,
H2O+CO↑,
a、依据制备反应可知,浓硫酸是脱水剂,由于甲酸密度小于浓硫酸,所以混合时把浓硫酸加入甲酸中;
b、反应是液体和液体混合加热制气体,所以需要的玻璃仪器有分液漏斗、圆底烧瓶、酒精灯、干燥管集气瓶;
c、一氧化碳是难溶于水的比空气略轻的气体,收集时用排水集气法;
(2)实验室还可用草酸晶体与浓H2SO4共热制取CO.H2C2O4 CO2↑+CO↑+H2O得到不含CO2的CO气体,需要把混合气体通过碱石灰或氢氧化钠溶液把二氧化碳除去;
CO2↑+CO↑+H2O得到不含CO2的CO气体,需要把混合气体通过碱石灰或氢氧化钠溶液把二氧化碳除去;
(3)工业上用焦炭和水在高温下发生反应制取CO,反应的化学方程式为:C+H2O CO+H2;在此条件下,C和H2的还原性,依据氧化还原反应中还原剂的还原性大于还原产物,所以还原性C>H2.
CO+H2;在此条件下,C和H2的还原性,依据氧化还原反应中还原剂的还原性大于还原产物,所以还原性C>H2.
点评:本题考查了实验室制取一氧化碳的反应原理和注意问题,实验装置的选择原则,关键是实验基本操作的熟练掌握,物质性质的应用.
 H2O+CO↑,
H2O+CO↑,a.浓硫酸是催化剂和吸水剂,由于甲酸密度小于浓硫酸,所以混合时把浓硫酸加入甲酸中;
b.实验装置是:液体+液体
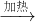 气体,需要的玻璃仪器为:分液漏斗(装甲酸)、圆底烧瓶(装浓H2SO4)、酒精灯、干燥管、集气瓶;
气体,需要的玻璃仪器为:分液漏斗(装甲酸)、圆底烧瓶(装浓H2SO4)、酒精灯、干燥管、集气瓶;c.一氧化碳是难溶于水的比空气略轻的气体,用排水法收集;
故答案为:a、将甲酸滴入热的浓H2SO4中;脱水作用;
b、分液漏斗(装甲酸)、圆底烧瓶(装浓H2SO4)、酒精灯、干燥管、集气瓶;
c、排水集气法;
(2)草酸晶体与浓H2SO4共热制取CO.H2C2O4
 CO2↑+CO↑+H2O,生成的产物为二氧化碳、一氧化碳、水蒸气,通过碱石灰或NaOH溶液,可以吸收二氧化碳和水蒸气,
CO2↑+CO↑+H2O,生成的产物为二氧化碳、一氧化碳、水蒸气,通过碱石灰或NaOH溶液,可以吸收二氧化碳和水蒸气,故答案为:通过碱石灰或NaOH溶液;
(3)焦炭和水在高温下发生反应制取CO,其化学方程式为:C+H2O
 CO+H2 ;氧化还原反应的还原剂的还原性大于还原产物所以还原性C>H2,
CO+H2 ;氧化还原反应的还原剂的还原性大于还原产物所以还原性C>H2,故答案为:C+H2O
 CO+H2,还原性C>H2.
CO+H2,还原性C>H2.分析:(1)CO是一种无色、无味且不溶于水的有毒气体,实验室可用甲酸和浓H2SO4共热制取CO.HCOOH
 H2O+CO↑,
H2O+CO↑,a、依据制备反应可知,浓硫酸是脱水剂,由于甲酸密度小于浓硫酸,所以混合时把浓硫酸加入甲酸中;
b、反应是液体和液体混合加热制气体,所以需要的玻璃仪器有分液漏斗、圆底烧瓶、酒精灯、干燥管集气瓶;
c、一氧化碳是难溶于水的比空气略轻的气体,收集时用排水集气法;
(2)实验室还可用草酸晶体与浓H2SO4共热制取CO.H2C2O4
 CO2↑+CO↑+H2O得到不含CO2的CO气体,需要把混合气体通过碱石灰或氢氧化钠溶液把二氧化碳除去;
CO2↑+CO↑+H2O得到不含CO2的CO气体,需要把混合气体通过碱石灰或氢氧化钠溶液把二氧化碳除去;(3)工业上用焦炭和水在高温下发生反应制取CO,反应的化学方程式为:C+H2O
 CO+H2;在此条件下,C和H2的还原性,依据氧化还原反应中还原剂的还原性大于还原产物,所以还原性C>H2.
CO+H2;在此条件下,C和H2的还原性,依据氧化还原反应中还原剂的还原性大于还原产物,所以还原性C>H2.点评:本题考查了实验室制取一氧化碳的反应原理和注意问题,实验装置的选择原则,关键是实验基本操作的熟练掌握,物质性质的应用.

练习册系列答案
相关题目
 共热制取CO.
共热制取CO.

 的CO气体?
的CO气体? 的还原性谁强?
的还原性谁强? 共热制取CO.
共热制取CO.

 的CO气体?
的CO气体? 的还原性谁强?
的还原性谁强?