题目内容
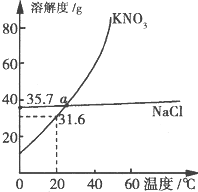
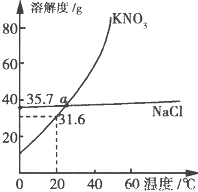
KN03和NaCl的溶解度曲线如图所示.下列说法正确的是( )
A.40℃时,将35 g NaCl溶于100 g水中,降温至0℃时,可析出晶体
B.20℃时饱和KN03溶液的溶质质量分数大于31.6%
C.a点KNO3和NaCl溶液的物质的量浓度相等
D.固体KNO3中混有NaCl,可用重结晶法进行分离提纯
【答案】分析:A.根据0℃时,NaCl的溶解度为35.7g;
B.依据饱和溶液中溶质的质量分数的计算式 ×100%及该温度下硝酸钾的溶解度分析解答;
×100%及该温度下硝酸钾的溶解度分析解答;
C.根据KNO3和NaCl的溶解度曲线的交点的意义分析;
D.依据硝酸钾和氯化钠的溶解度随温度变化情况分析物质分离的方法.
解答:解:A.0℃时,NaCl的溶解度为35.7g,40℃时,将35 g NaCl溶于100 g水中,降温至0℃时,溶液未饱和,不析出晶体,故A错误;
B.20℃时硝酸钾的溶解度是31.6g,所以饱和溶液中溶质的质量分数是 ×100%<31.6%,故B错误;
×100%<31.6%,故B错误;
C.由KNO3和NaCl的溶解度曲线可知,在22℃时,KNO3和NaCl的溶解度曲线交与一点,在此温度下,KNO3和NaCl的溶解度相同.两种饱和溶液的质量百分数相同,物质的量浓度不等,故C错误;
D.KNO3的溶解度随温度变化较大,NaCl的溶解度随温度变化不大,故KNO3溶液中含有少量NaCl,可用冷却热饱和溶液的方法提纯KNO3,故D正确;
故选D.
点评:解答本题的关键是要知道溶解度曲线表示的意义,交点的含义,溶质质量分数的计算.
B.依据饱和溶液中溶质的质量分数的计算式
 ×100%及该温度下硝酸钾的溶解度分析解答;
×100%及该温度下硝酸钾的溶解度分析解答;C.根据KNO3和NaCl的溶解度曲线的交点的意义分析;
D.依据硝酸钾和氯化钠的溶解度随温度变化情况分析物质分离的方法.
解答:解:A.0℃时,NaCl的溶解度为35.7g,40℃时,将35 g NaCl溶于100 g水中,降温至0℃时,溶液未饱和,不析出晶体,故A错误;
B.20℃时硝酸钾的溶解度是31.6g,所以饱和溶液中溶质的质量分数是
 ×100%<31.6%,故B错误;
×100%<31.6%,故B错误;C.由KNO3和NaCl的溶解度曲线可知,在22℃时,KNO3和NaCl的溶解度曲线交与一点,在此温度下,KNO3和NaCl的溶解度相同.两种饱和溶液的质量百分数相同,物质的量浓度不等,故C错误;
D.KNO3的溶解度随温度变化较大,NaCl的溶解度随温度变化不大,故KNO3溶液中含有少量NaCl,可用冷却热饱和溶液的方法提纯KNO3,故D正确;
故选D.
点评:解答本题的关键是要知道溶解度曲线表示的意义,交点的含义,溶质质量分数的计算.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
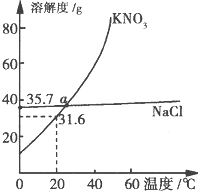 KN03和NaCl的溶解度曲线如图所示.下列说法正确的是( )
KN03和NaCl的溶解度曲线如图所示.下列说法正确的是( )