��Ŀ����
298 Kʱ��ij�ݻ��̶�Ϊ1 L���ܱ������з������¿��淴Ӧ��A(g) 2B(g)����H��-a kJ��mol��1������B�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��
2B(g)����H��-a kJ��mol��1������B�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��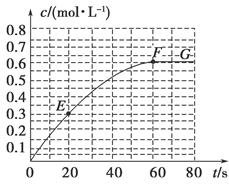
�Իش��������⡣
��1����֪298 Kʱ60 s�ﵽƽ�⣬�Ƚ�40��60 s�ں�60��80s��B��ƽ����Ӧ����:v(40��60) v(60��80)(�������������)��
��2����298 K�ﵽƽ��ʱ��B��ƽ��Ũ��ΪA��3�������ų�����x kJ����ʼ����A�����ʵ����� mol��
��3��298kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ mol/L��
��4������Ӧ��298 K���У���1 L�ܱ������м���1 mol B��0.2 mol Ne���ﵽƽ��ʱ����������y kJ����ʱB��ת����Ϊ (�����)��
A������60% B������40%
C��С��40% D������40%��60%֮��
��5����ϣ�2������4��������ݣ�д��a��x��y���ߵĵ�ʽ��ϵʽ�� ��
��6������Ӧ��298K���У���Ӧ��ʼŨ��Ϊc(A)=c(B)=1.0mol/L����ѧƽ�⽫ (�����������)�ƶ���
��7����֪��������������֮�����ߵ�б�ʱ�ʾ��ʱ�����B��ƽ����Ӧ����(����ֱ��EF��б�ʱ�ʾ20 s��60 s��B��ƽ����Ӧ����)��������������һ�������б�ʵ������� ��
��1���� ��2��0.5 ��3��1.8 ��4��B ��5��a=2x+2y ��6������
��7��ijһʱ�̵ķ�Ӧ����(��ʱ���ʡ�˲ʱ����)��
���������������1��40��60 s��B��Ũ����0.53mol��L-1��Ϊ0.6mol��L-1��60��80s��B��Ũ�Ȳ��ٱ仯����v(40��60)��v(60��80)��
��2��ƽ��Ũ��c(B)="3c(A)=" 0.6mol��L-1��1L�У��ɷ�Ӧ����Ӧ����0.6mol Bת��Ϊ0.3mol A����ʼ����A�����ʵ�����0.50mol��
��3��298kʱ���÷�Ӧ��ƽ�ⳣ��K=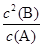 =
=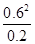 =1.8mol/L��
=1.8mol/L��
��4��ԭ��Ӧ����ʼʱ��c(A)=0.5��ƽ��ʱת��0.3 mol��L-1��ת����Ϊ60%����100%��ת���õ�1molB����1 L�ܱ������м���1 mol B��0.2 mol Ne����Ne�أ���ˣ�����ƽ���Ч����һ��ת����Ϊ40%��
��5����������4��������֪a=2x+2y��
��6��c(A)=c(B)=1.0mol/L��Qc=1.8mol/L��K����ѧƽ�������ƶ���
��7���������ɣ�����������һ�������б�ʵ������Ǹ�ʱ�̵ķ�Ӧ���ʡ�
���㣺��ѧ��Ӧ������ƽ����㡣

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���֪A(g)+B(g) C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| �¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1��7 | 1��1 | 1��0 | 0��6 | 0��4 |
�ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H 0���<���� >���� =��)��
��2��830��ʱ����һ��5 L���ܱ������г���0��20mol��A��0��80mol��B������Ӧ��ʼ6s��A��ƽ����Ӧ����v(A)=0��003 mol��L-1��s-1������6sʱ c(A)= mol��L-1�� C�����ʵ���= mol��
����һ��ʱ���Ӧ�ﵽƽ�⣬���ʱA��ת����= �������ʱ����ܱ��������ٳ���1 mol�����ƽ��ʱA��ת���� �� ����С�����䡱����
��3���жϸ÷�Ӧ�ﵽƽ�������Ϊ ������ȷѡ��ǰ����ĸ)��
A��ѹǿ����ʱ��ı�
B��������ܶȲ���ʱ��ı�
C��c(A)����ʱ��ı�
D����λʱ��������C��D�����ʵ������
��4��1200��ʱ��ӦC(g)+D(g)
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ �� ��2 L�ܱ�������,800 ��ʱ��Ӧ2NO(g)+O2(g) 2NO2(g)��ϵ��,n(NO)��ʱ��ı仯���±�:
2NO2(g)��ϵ��,n(NO)��ʱ��ı仯���±�:
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)��ͼ��ʾNO2��Ũ�ȱ仯��������������������O2��ʾ��0~2 s�ڸ÷�Ӧ��ƽ������v=����������
(2)��˵���÷�Ӧ�Ѵﵽƽ��״̬��������������
a.v(NO2)=2v(O2) ����b.������ѹǿ���ֲ���
c.v��(NO)=2v��(O2) ����d.�������ܶȱ��ֲ���
�ϳɰ����������Ĵ����������˹��̵���;�����Ի�ѧ��ҵ����Ҳ�������ش�Ӱ�졣�ϳɰ���Ӧ�Ļ�ѧ����ʽΪN2(g)��3H2(g) 2NH3(g)����H����92.2 kJ��mol��1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶá�
2NH3(g)����H����92.2 kJ��mol��1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶá�
(1)��һ�ݻ��̶����ܱ�������ע��N2��H2�������壬����������Ӧ����ij�¶��´ﵽƽ��ʱ�������ʵ�Ũ�ȷֱ��ǣ�c(H2)��9.00 mol��L��1��c(N2)��3.00 mol��L��1��c(NH3)��4.00 mol��L��1�����¶��¸÷�Ӧ��ƽ�ⳣ��K��________��
(2)��������ͬ�����и�����1 mol N2��3 mol H2���ڲ�ͬ�����·�Ӧ���ﵽƽ�⣬�������������ʱ��仯��������ͼ��ʾ������˵������ȷ����________(����ĸ)��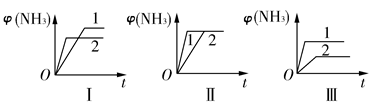
| A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p2>p1 |
| B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p1>p2 |
| C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1>T2 |
| D��ͼ�������ͬ��ͬѹ�²�ͬ�����Է�Ӧ��Ӱ�죬�Ҵ�������1>2 |
��H����131.3 kJ��mol��1����S����133.7J��K��1 ��mol��1
�÷�Ӧ�ڳ������ܷ��Է����У�________(��ܡ����ܡ�)��
��ѧѧ���еĻ�ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ����
��ش��������⣺ ��1����ҵ�ϲ�ȡCO��H2Ϊԭ�Ϻϳ��Ҵ����仯ѧ��Ӧ����ʽΪ��2CO��g����4H2��g��??
��1����ҵ�ϲ�ȡCO��H2Ϊԭ�Ϻϳ��Ҵ����仯ѧ��Ӧ����ʽΪ��2CO��g����4H2��g��??
CH3CH2OH��g����H2O��g������д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK��________��
��2�������£�Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
����������Һ�е������ӣ��������������ǿ����________��
�ڸ��ݱ������ݣ�Ũ�Ⱦ�Ϊ0.01 mol��L��1�������������ʵ���Һ�У�������ǿ����________������ĸ����������Һ�ֱ�ϡ��100����pH�仯��С����________������ĸ����
A��HCN B��HClO C��H2SO4 D��CH3COOH E��H2CO3
�۰�CO2����ͨ�뱥��̼������Һ�У����Թ۲쵽������Ϊ________��ԭ��Ϊ________�������ӷ���ʽ��ʾ����
��Ҫ������ˮ��HClO��Ũ�ȣ�������ˮ�м���������̼������Һ����Ӧ�����ӷ���ʽΪ____________��
��3��ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵���������_______��

A����������BaCl2�����壩����ʹ��Һ��d��䵽c��
B��ͨ����ˮϡ�Ϳ���ʹ��Һ��b��䵽a��
C��d����BaSO4��������
D��a���Ӧ��Ksp����c���Ӧ��Ksp
һ���¶���,��2 L���ܱ�������,X��Y��Z�������������ʱ��仯��������ͼ��ʾ: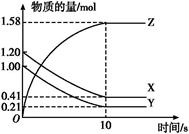
(1)�ӷ�Ӧ��ʼ��10 sʱ,��Z��ʾ�ķ�Ӧ����Ϊ����������������,X�����ʵ���Ũ�ȼ�������������,Y��ת����Ϊ������
(2)�÷�Ӧ�Ļ�ѧ����ʽΪ��
(3)10 s���ijһʱ��(t1)�ı����������,��������ʱ��ı仯ͼ����ͼ��ʾ: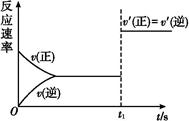
������˵�����ϸ�ͼ���������������
| A��t1ʱ��,������X��Ũ�� | B��t1ʱ��,��������ϵ�¶� |
| C��t1ʱ��,��С��������� | D��t1ʱ��,ʹ���˴��� |
 C(g)��D(g)����H��0����ش��������⣺
C(g)��D(g)����H��0����ش��������⣺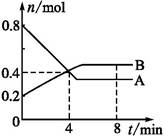
 cC(s)+dD,����Ӧ���е���t minʱ,���A������n mol,B������n/2 mol,C������3n/2 mol,D������n mol����ʱ��Ӧ�ﵽƽ�⡣
cC(s)+dD,����Ӧ���е���t minʱ,���A������n mol,B������n/2 mol,C������3n/2 mol,D������n mol����ʱ��Ӧ�ﵽƽ�⡣