题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| B.甲基橙呈黄色的溶液:I-、Ba2+、AlO2-、Cl- |
| C.c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br- |
| D.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
C
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中溶液显酸性,也可能显碱性。如果显酸性,在酸性条件下,NO3-和铝反应得不到氢气,且CO32-也不能大量共存,但溶液显碱性使可以的。B中使甲基橙呈红色的溶液显酸性,AlO2-不能大量共存;C中溶液显碱性,可以大量共存;D中溶液显酸性,在酸性条件下,NO3-能氧化Fe2+,不能大量共存。答案选C。
考点:考查离子共存的正误判断

 备战中考寒假系列答案
备战中考寒假系列答案在由水电离产生的H+浓度为1 ×10-13mol·L-1的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42- ③Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |
为使溶液中的3种阳离子A+、B2+、C3+逐一沉淀分离,将含有A+、B2+、C3+离子的水溶液进行如下实验, 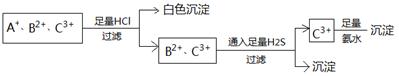
关于三种离子的判断正确的是
| A.Ag+、Fe2+、Al3+ | B.NH4+、Fe2+、Fe3+ |
| C.Ag+、Cu2+、Fe3+ | D.Ag+、Cu2+、Al3+ |
下列反应中,离子方程式正确的是
| A.大理石溶于盐酸中:CO32-+2H+= CO2↑+H2O |
| B.AlCl3溶液中加入过量氨水:Al3++3NH3?H2O =Al(OH)3↓+ 3NH4+ |
| C.硫酸镁溶液与氢氧化钡溶液混合:SO42- + Ba2+ =BaSO4↓ |
| D.氯化铁溶液中加入铜片:Fe3++Cu = Fe2++Cu2+ |
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.溶液中无法确定Al3+的存在与否 |
| B.原溶液中不含的离子为:K+、Al3+、CO32- |
| C.步骤②中可以确定Fe2+、NO3-的存在 |
| D.步骤③中共有2种钡盐沉淀 |
下列离子反应方程式正确的是 ( )
A.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42- Cu2++ SO2↑+ 2H2O Cu2++ SO2↑+ 2H2O |
B.电解饱和食盐水:2Cl- +2H+ H2↑+C12↑ H2↑+C12↑ |
| C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+ |
| D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
在pH=13的无色溶液中,下列各组离子能大量共存的是
A.K+、Na+、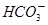 、 、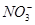 | B.Na+、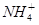 、 、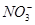 、Cl- 、Cl- |
C.K+、Na+、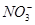 、Br- 、Br- | D.K+、Cu2+、Cl-、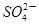 |
下列电离方程式书写不正确的是
| A.CuCl2== Cu2+ +2Cl- | B.Ba(OH)2="=" Ba2++(OH)2- |
| C.Al2(SO4)3="=" 2A13++3SO42- | D.HNO3="=" H++NO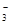 |