题目内容
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.溶液中无法确定Al3+的存在与否 |
| B.原溶液中不含的离子为:K+、Al3+、CO32- |
| C.步骤②中可以确定Fe2+、NO3-的存在 |
| D.步骤③中共有2种钡盐沉淀 |
B
解析试题分析:用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰,则说明有K+;另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3-和还原性的Fe2+;若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32-或SO42-,因为有Fe2+,Fe2+与CO32-不能共存,所以没有CO32-;则溶液中的离子有Fe2+、NO3-、SO42-,已知各种离子的物质的量浓度相等,阴离子电荷比阳离子电荷多,所以还有另外的阳离子Cu2+或Al3+,若有Cu2+,阳离子的电荷多还须有Cl-,若有Al3+,阴离子加上Cl-,电荷仍不守恒;所以根据电荷守恒可知还有Cu2+、Cl-,所以原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42-,原溶液中不含的离子为:K+、Al3+、CO32-,故B正确;故选B。
考点:本题考查了离子检验的实验方法和反应现象分析,掌握离子性质和溶液中电荷守恒计算判断存在的离子是解题关键,题目难度较大。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案在碱性条件下,溶液无色且可以大量共存的离子组是
| A.K+、Ca2+、Cl-、HCO3- | B.Cu2+、Cl-、Na+、SO42- |
| C.Ba2+、Na+、Cl-、NO3- | D.Na+、Mg2+、NO3-、Cl- |
如图,将2 mL浓度为6 mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失。对该反应过程的推断不合理的是: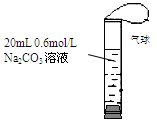
| A.有反应CO32- + 2H+ → CO2↑ + H2O发生 |
| B.有反应CO32- + H+ → HCO3-发生 |
| C.有反应CO32- + CO2 + H2O→ 2HCO3-发生 |
| D.加快盐酸注入速度不会改变反应现象 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| B.甲基橙呈黄色的溶液:I-、Ba2+、AlO2-、Cl- |
| C.c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br- |
| D.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
下列表示对应反应的离子方程式正确的是
| A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+=I2+2H2O |
| B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH4+ |
C.用惰性电极电解氯化镁溶液:2Cl—+2H2O H2↑+Cl2↑ +2OH— H2↑+Cl2↑ +2OH— |
D.碳酸氢钠的水解:HCO3—+H2O CO32— +H3O+ CO32— +H3O+ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙变黄的溶液中:Na+、K+、SO42-、Al3+ |
| B.pH=2的溶液中:Na+、ClO-、NH4+、SO42- |
| C.某透明澄清的溶液中:NH4+、Cu2+、NO3-、Cl- |
| D.0.1 mol·L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
下列反应的离子方程式中,书写正确的是( )。
| A.钾跟水反应 2K+2H2O=2K++2OH-+H2↑ |
| B.铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钙溶液跟碳酸反应 Ca2++CO32-=CaCO3↓ |
| D.碳酸钙跟盐酸反应 CO32-+2H+=H2O+CO2↑ |