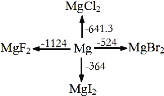
题目内容
【题目】铜是人类最早发现并广泛使用的一种金属。回答下列问题:
(1)CuFeS2是其中铜的主要存在形式。CuFeS2中存在的化学键类型是__。铜原子核外电子排布式为___。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是__,中心原子杂化类型为__。
②X的沸点比水低的主要原因是__。
(3)[Cu(NH3)4]2+中,提供孤对电子的是__。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是__(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是__。
(4)某镍白铜合金的立方晶胞结构如图所示。
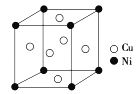
①晶胞中铜原子与镍原子的数量比为__。
②若合金的密度为dg·cm-3,晶胞边长a=__nm。(设NA代表阿伏加德罗常数)
【答案】离子键 1s22s22p63s23p63d104s1 V形 sp3 水分子间存在氢键 NH3 极性 平面正方形 3∶1 ![]() ×107
×107
【解析】
根据CuFeS2中元素构成,可判断化学键类型,Cu是29号元素,可写出它的核外电子排布式;根据H2S中中心原子硫的价层电子对数,由VSEPR判断其空间构型和杂化类型;根据水分子间能形成氢键,则沸点高;根据配位键形成的实质,判断谁提供了孤对电子;根据[Cu(NH3)4]2+中的两个NH3被两个Cl取代,能得到两种不同结构的产物,判断其空间构型;根据相似相溶原理,判断分子的极性;由均摊法求出原子个数比,根据化学式和密度,求出晶胞的边长。
(1)CuFeS2中硫为非金属元素,铁和铜为金属元素,它们之间形成的化学键为离子键,Cu是29号元素,Cu原子核外电子排布式是1s22s22p63s23p63d104s1;答案为离子键,1s22s22p63s23p63d104s1。
(2)①CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X是H2S,H2S分子中S原子价层电子对数为4,VSEPR模型为四面体形。但S原子有2对孤电子对,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,导致H2S分子的构型为V形,S原子价层电子对数的4,所以中心原子硫杂化类型为sp3杂化;答案为V形,sp3。
②H2S的沸点比水低的主要原因是水分子间形成氢键,而H2S分子之间只存在分子间作用力,答案为水分子间存在氢键。
(3)在[Cu(NH3)4]2+中,铜离子提供空轨道,氨气分子中的氮元素提供孤电子对;Cu(NH3)2Cl2的同分异构体可溶于水,根据相似相溶原理,水是极性分子,所以该分子为极性分子;既然存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型是平面正方形,若是正面体空间构型,Cu(NH3)2Cl2的结构只有一种;答案为NH3;极性;平面正方形。
(4)①该晶胞中Ni原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,则铜原子与镍原子的数量比为3:1;答案为3:1。
=3,则铜原子与镍原子的数量比为3:1;答案为3:1。
②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,根据V=a3,则晶胞边长a=![]() =
=![]() =
=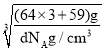 =
=![]() cm=
cm=![]() ×107nm,答案为
×107nm,答案为![]() ×107。
×107。

【题目】“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A | B | C | D |
|
|
|
|
用灼烧法可鉴别羊毫与尼龙毫的真伪 | 墨的主要成分是碳单质 | 纸的主要成分属于合成材料 | 用石材制作砚台的过程是物理变化 |
A.AB.BC.CD.D