题目内容
【题目】根据下图所示各装置和实验室制取氧气的原理,回答下列问题:

(1) 仪器B的名称为______________。
(2) 用mgMnO2和n g KC1O3组成的固体混合物加热制取氧气时,可选用的实验装置是_____(填装罝序号)。
(3) 将MnO2和KC1O3的混合物充分加热至不再产生氧气时,若要将其中的催化剂MnO2回收再利用,应进行的实验操作是将固体冷却、加水溶解、______、洗涤、干燥。证明MnO2固体已洗涤干净的操作方法为____________________。
(4) 将(2)中的固体混合物加热一段时间,冷却后称得剩余固体为p g,则当(m+n-p):n=___时,表明KC1O3已完全分解。
(5) 用双氧水和MnO2制取氧气时,不能选用装置c,其原因是________________。
(6) 用装置d制取氨气时,所需的化学药品是__________________________。用电子式表示氨气的形成过程__________________________________________。
【答案】长颈漏斗b过滤取最后一次的洗涤液,加硝酸、硝酸银无白色沉淀生成,则洗涤干净96:245c中MnO2粉末固体与液体接触后不能关闭止水夹使固体与液体分离,则不选c装置浓氨水与氢氧化钠固体(或生石灰或碱石灰)![]() +3
+3![]() →
→![]() 。
。
【解析】
(1)由图可知使用的实验仪器;(2)固体混合物加热制取氧气,选择固体加热装置;(3)MnO2和KClO3的混合物充分加热至不再产生氧气时,固体为KCl和MnO2,MnO2不溶于水;利用过滤器洗涤,利用最后一次的洗涤液检验是否洗净;(4)利用质量守恒定律分析;(5)用双氧水和MnO2制取氧气时,选择固体与液体反应且不加热装置;(6)用装置d制取氨气时,为固体与液体反应且不加热装置;氮原子与氢原子以共价键形成氨气。
(1)由图可知仪器B为长颈漏斗;(2)固体混合物加热制取氧气,选择固体加热装置,只有b装置符合,故答案为:b;(3)MnO2和KClO3的混合物充分加热至不再产生氧气时,固体为KCl和MnO2,MnO2不溶于水,则溶解后过滤、洗涤、干燥可回收催化剂;证明MnO2已洗涤干净的实验方法为取最后一次的洗涤液,加硝酸、硝酸银无白色沉淀生成,则洗涤干净;(4)表明KClO3已完全分解,剩余固体质量pg中含KCl为(p-m)g,则氧气质量为(n+m -p)g,由反应可知生成氧气为![]() g,所以满足(n-p+m)=
g,所以满足(n-p+m)=![]() 即(m+n-p):n=96:245时,表明KC1O3已完全分解;(5)用双氧水和MnO2制取氧气时,选择固体与液体反应且不加热装置,只有d符合,而c中MnO2粉末固体与液体接触后不能关闭止水夹使固体与液体分离,则不选c装置;(6) 用装置d制取氨气时,为固体与液体反应且不加热装置,所需的化学药品是浓氨水与氢氧化钠固体(或生石灰或碱石灰);用电子式表示氨气的形成过程为
即(m+n-p):n=96:245时,表明KC1O3已完全分解;(5)用双氧水和MnO2制取氧气时,选择固体与液体反应且不加热装置,只有d符合,而c中MnO2粉末固体与液体接触后不能关闭止水夹使固体与液体分离,则不选c装置;(6) 用装置d制取氨气时,为固体与液体反应且不加热装置,所需的化学药品是浓氨水与氢氧化钠固体(或生石灰或碱石灰);用电子式表示氨气的形成过程为![]() +3
+3![]() →
→![]() 。
。

【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

实验步骤:
在A中加入4.4 g异戊醇(3-甲基-1-戊醇)、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的具体名称是____________,实验时冷却水的进水口是_____(a或b)。
(2)在洗涤操作中,先水洗再饱和NaHCO3溶液洗而不是直接用饱和NaHCO3溶液洗涤的原因是____________________。
(3)该制备反应的化学反应方程式为__________________________。
(4)本实验中加入过量乙酸的目的是___________________________。
(5)本实验中不能用生石灰代替无水MgSO4的原因________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是___________(填标号)。

(7)本实验的产率是___________(填标号)。
a.90% b.60% c.40% d.30%
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
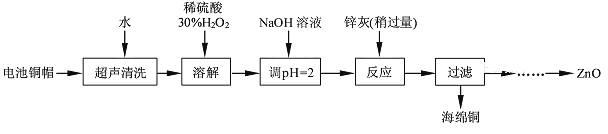
(1)铜帽溶解时加入H2O2的目的是_________________________(用化学方程式表示)。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2;2S2O32-+I2=2I-+S4O62-。
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为_______________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会_______(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30%H2O2,使其充分反应;②滴加1.0mol·L-1NaOH,调节溶液pH范围:________;③过滤;④向滤液中滴加1.0mol·L-1NaOH,调节溶液pH范围:___________;⑤过滤、洗涤、干燥;⑥900℃煅烧。