题目内容
8.现有短周期元素构成的3种单质甲、乙、丙,它们在一定条件下能发生如下变化,部分产物已略去.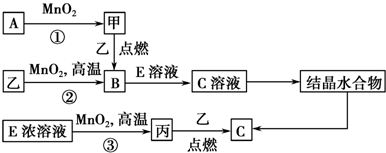
(1)若反应①可在常温下进行,则A的电子式为
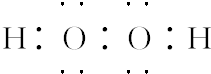 .若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
.若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.(2)反应②的化学方程式为4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,该反应是放热(填“放热”或“吸热”)反应.
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化为C.从C溶液中得到晶体的过程被称为结晶
(4)反应③中氧化剂与还原剂的物质的量之比为1:2.
分析 三种单质甲、乙、丙,A和二氧化锰反应生成,甲单质和乙点燃反应说明甲为氧气,若反应①可在常温下进行,A为H2O2,甲为O2,若反应①需在加热条件下进行,则A为KClO3,反应②在高温下进行,该反应为铝热反应,所以乙为Al,B为Al2O3,E的浓溶液能与二氧化锰反应生成丙,则E为浓盐酸,丙为Cl2,C为AlCl3,据此答题.
解答 解:三种单质甲、乙、丙,A和二氧化锰反应生成,甲单质和乙点燃反应说明甲为氧气,若反应①可在常温下进行,A为H2O2,甲为O2,若反应①需在加热条件下进行,则A为KClO3,反应②在高温下进行,该反应为铝热反应,所以乙为Al,B为Al2O3,E的浓溶液能与二氧化锰反应生成丙,则E为浓盐酸,丙为Cl2,C为AlCl3,
(1)若反应①可在常温下进行,A为H2O2,A的电子式为  ,若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
,若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
故答案为: ;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)反应②的化学方程式为4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,该反应是放热反应,
故答案为:4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;放热;
(3)从AlCl3溶液中得到晶体的过程被称为结晶,
故答案为:结晶;
(4)反应③的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据方程式可知,反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:1:2.
点评 本题考查了物质性质的判断应用,物质转化关系的特征应用,反应条件和反应试剂是解题关键,注意特征反应的熟练掌握.

| A. | 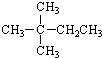 | B. |  | C. | CH3CH2CH2CH2CH3 | D. | CH3CH2CH2CH3 |
| A. | 铜锌组成的原电池中电子是从锌经过导线流向铜 | |
| B. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| C. | 把铜片插入FeCl3溶液中,在铜片表面出现一层铁 | |
| D. | 把锌片放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快 |
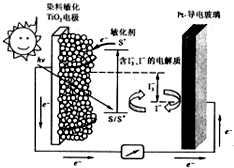 如图是一种染料敏化太阳能电池的示意图.电池的一个点极由有机光敏燃料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
如图是一种染料敏化太阳能电池的示意图.电池的一个点极由有机光敏燃料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:TiO2/S→TiO2/S+(激发态)
TiO2/S+→TiO2/S++e-
I3-+2e-→3I-
TiO2/S++3I-→TiO2/S+3I3-
下列关于该电池叙述错误的是( )
| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 电池中镀铂导电玻璃为正极 | |
| C. | 电池工作时,I-离子在镀铂导电玻璃电极上放电 | |
| D. | 电池的电解质溶液中I-和I3-的浓度不会减少 |
| A. | C(Na+)>C(HCO3-)>C(CO32-)>C(H+)>C(OH-) | B. | C(Na+)>C[H+]=C[HCO3-]+C[CO32-]+C[OH-] | ||
| C. | C[Na+]+C[H+]=C[HCO3-]+2C[CO32-]+C[OH-] | D. | C[Na+]=C[HCO3-]+C[CO32-] |
| A. | 0.l mol•L-1醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 等体积等pH的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 | |
| C. | 将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-a mol•L-1,若a>7时,则该溶液的pH一定为14-a |
 用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质: