题目内容
| A、为防止钢铁生锈可以在设备上装上铜合金或铜块 | B、氢氧燃料电池装置中,正负极可以同时选用Pt材料做电极 | C、电解熔融氯化钠制钠,用铁丝网做阳极,液体钠从阴极室流出 | D、电解精炼铜时,同一时间内阳极溶解的铜与阴极析出铜的质量相等 |
B.氢氧燃料电池装置中,使用惰性电极,两个电极可以相同;
C.Fe作阳极时Fe失电子;
D.阴极和阳极的电子得失守恒,阳极是不纯的铜,含有其他金属或者非金属,阳极失去的电子由铜和其他金属承担;阴极析出较纯的铜单质,电子全部由较纯的铜提供.
B.氢氧燃料电池装置中,使用惰性电极,两个电极可以相同,则正负极可以同时选用Pt材料做电极,故B正确;
C.Fe作阳极时Fe失电子,所以电解熔融氯化钠制钠,用惰性电极做阳极,钠离子在阴极得电子生成钠单质,则液体钠从阴极室流出,故C错误;
D.阴极和阳极的电子得失守恒,阳极是不纯的铜,含有其他金属或者非金属,阳极失去的电子由铜和其他金属承担;阴极析出较纯的铜单质,电子全部由较纯的铜提供;因此阳极溶解的铜肯定比阴极析出的纯铜质量少,故D错误;
故选:B.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,
体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K = 。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,
水蒸气的总转化率α (H2O) 。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1 573K(填“>”、“<”或“=”)。
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化
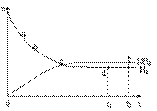 的关系如下图所示依据上图,下列有关叙
的关系如下图所示依据上图,下列有关叙
述正确的是(填写序号) 。
A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
。
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u