题目内容
19.将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL氧气.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )已知:NO在 O2存在时与水可按4NO+3O2+2H2O=4HNO3反应进行.
| A. | 231.5mL | B. | 268.8mL | C. | 287.5mL | D. | 313.6mL |
分析 根据分析可知,混合气体的总物质的量为0.02mol,而剩余的氧气的物质的量为0.002mol,故反应的O2和NH3的物质的量之和为0.02mol-0.002mol=0.018mol,设氧气的物质的量为xmol,氨气的物质的量为ymol,则有x+y=0.018mol,而NH3反应后最终变为+5价、O2反应后变为-2价,根据反应得失电子数守恒来解题.
解答 解:根据分析可知,混合气体的总物质的量为n=$\frac{0.448L}{22.4L/mol}$=0.02mol,而剩余的氧气的物质的量为n=$\frac{0.0448L}{22.4L/mol}$=0.002mol,故反应掉的O2和NH3的物质的量之和为0.02mol-0.002mol=0.018mol,设氧气的物质的量为xmol,氨气的物质的量为ymol,则有x+y=0.018mol ①
由于NH3反应后最终变为+5价、O2反应后变为-2价,根据反应得失电子数守恒可得:4x=8y ②
解①②可知:x=0.012mol,y=0.006mol
故氧气的总量为0.012mol+0.002mol=0.014mol,在标况下的体积V=nVm=0.014mol×22.4L/mol=313.6mL,故选D.
点评 本题表面上考查了根据化学方程式的有关计算,但实际根据得失电子数守恒来计算最为简单,难度适中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法正确的是( )
| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取SP3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、CCl4、C6H6都是只含有极性键的非极性分子 |
7.只含C、H、O三种元素的有机物W,其蒸气的密度是NH3的6倍(相同条件下),取一定量的有机物W完全燃烧,生成CO2和H2O的质量比为22:9,则W能发生水解反应的结构(不考虑立体结构) 共有( )
| A. | 11种 | B. | 10种 | C. | 9种 | D. | 8种 |
14.下列叙述正确的是( )
| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | CaCO3在水中的溶解度很小,故CaCO3为弱电解质 |
4.分类是化学学习与研究的常用方法,下列分类正确的是( )
| A. | Cl2O7、P2O5、SO3、CO2均属于酸性氧化物 | |
| B. | Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
11.下列电离方程式书写正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | Al2(SO4)3═Al3++SO42- | D. | NH3•H2O═NH4++OH- |
9.下列有关实验装置的说法中正确的是( )
| A. | 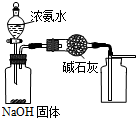 用图装置制取干燥纯净的NH3 | |
| B. | 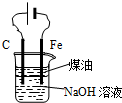 用图装置实验室制备Fe(OH)2 | |
| C. |  用图装置可以完成“喷泉”实验 | |
| D. |  用图装置测量Cu与浓硝酸反应产生气体的体积 |