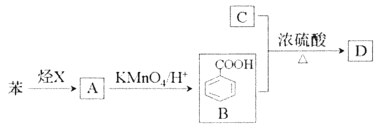
题目内容
【题目】为探究不含结晶水盐A(仅含三种元素)组成和性质,设计并完成如下实验:①取少量A,加水,A由白色变为蓝色,加热蓝色又变成白色;②另取一定量A进行加热分解,加热分解过程中有黄色中间产物B产生,同时产生气体C,B的质量为A质量的四分之三,C能使盐酸酸化的BaCl2溶液产生白色沉淀。B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO42-溶于水。
(1)A组成元素是_____(用元素符号表示)。
(2)B的化学式是______。
(3)B与水反应的化学方程式是______。
【答案】Cu S O Cu2OSO4 ![]() 或
或![]() 或
或![]()
【解析】
少量A,加水,A由白色变为蓝色,加热蓝色又变成白色,这是硫酸铜晶体吸水和脱水的现象,说明A是CuSO4;另取一定量A进行加热分解,加热分解过程中有黄色中间产物B产生,同时产生气体C,B的质量为A质量的四分之三,那么有B的质量为![]() =120,C的质量为
=120,C的质量为![]() =40;C能使盐酸酸化的BaCl2溶液产生白色沉淀,说明C为SO3,根据原子守恒可确定B的化学式;B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO42-溶于水,根据原子守恒可确定方程式。
=40;C能使盐酸酸化的BaCl2溶液产生白色沉淀,说明C为SO3,根据原子守恒可确定B的化学式;B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO42-溶于水,根据原子守恒可确定方程式。
(1)少量A,加水,A由白色变为蓝色,加热蓝色又变成白色,这是硫酸铜晶体吸水和脱水的现象,说明A是CuSO4,含有的元素是Cu、S、O;
(2)另取一定量A进行加热分解,加热分解过程中有黄色中间产物B产生,同时产生气体C,B的质量为A质量的四分之三,那么有B的质量为![]() =120,C的质量为
=120,C的质量为![]() =40;C能使盐酸酸化的BaCl2溶液产生白色沉淀,说明C为SO3,根据原子守恒有: 2CuSO4=SO3+2CuOSO3,B的化学式为Cu2OSO4;
=40;C能使盐酸酸化的BaCl2溶液产生白色沉淀,说明C为SO3,根据原子守恒有: 2CuSO4=SO3+2CuOSO3,B的化学式为Cu2OSO4;
(3)B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO42-溶于水,根据原子守恒有3Cu2OSO4+3H2O=3Cu(OH)2CuSO4+2CuSO4或者3Cu2OSO4+4H2O=3Cu(OH)2CuSO4H2O+2CuSO4或者3Cu2OSO4+3H2O=Cu4(OH)6SO4H2O+2CuSO4。

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案