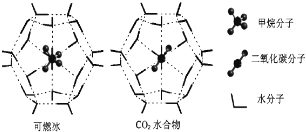
题目内容
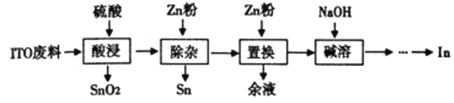
【题目】铟(In)主要应用于透明导电图层、荧光材料、有机合成等,以ITO靶材废料(主要由In2O3、SnO2组成)为原料回收铟的工艺流程如图:
已知:i. 锡、锌的性质均与铝的性质相似.
ii. 铟不与强碱反应,氢氧化铟难与强碱性溶液反应,在较浓的氢氧化钠溶液中也只有少量溶解。
iii. Ksp[In(OH)3]=1×10-33 Ksp[Sn(OH)4]=1×10-56
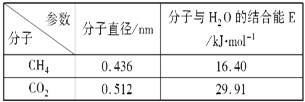
(1)海绵状ITO[xIn2O3(1-x)SnO2]可作异佛尔酮二胺合成的催化剂,如图表示相同条件下,两种不同方法制得的催化剂催化异佛尔酮二胺的相对初始速率随x的变化曲线。真空蒸馏法的相对初始速率较大的原因可能是_________,In2O3、SnO2两种氧化物中,催化效果更好的是__________;
(2)酸浸时,铟的浸出率随温度和硫酸浓度的关系如表,锡的浸出率小于20%。
30℃ | 50℃ | 70℃ | 90℃ | |
3 mol/L H2SO4 | 56% | 72% | 83% | 91% |
4 mol/L H2SO4 | 68% | 81% | 89% | 94% |
①写出“浸出”反应的化学方程式:___________________________;
②由上表信息可得出规律:其他条件不变时,铟的浸出率随温度升高而_____________(填“增大”“减小”或“不变”下同),温度越高,硫酸浓度对铟的浸出率影响__________;
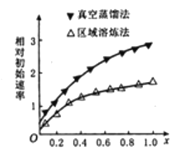
(3)现有一份In2(SO4)3和Sn2(SO4)2的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量关系如图所示:
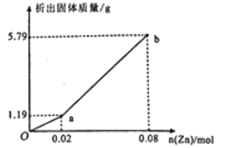
该混合溶液中,In3+和Sn4+的物质的量浓度之比为_______________;
(4)若“浸酸”后的溶液中In2(SO4)3的浓度为1 mol/L,取100 mL该溶液向其中滴加氨水,当Sn4+沉淀完全[设c(Sn4+)=1×10-6 mol/L]时,溶液的pH=____________,此时In3+是否开始形成沉淀_____(填“是”或“否”);
(5)“碱熔”时主要反应的离子方程式为___________;
(6)以粗铟为阳极,纯铟为阴极,H2SO4、NaCl和InCl3混合液为电解液可提纯粗铟。写出阴极反应的电极方程式:___________。
【答案】真空蒸馏法制取得到的催化剂纯度高 In2O3 In2O3+3H2SO4=In2(SO4)3+3H2O、SnO2+2H2SO4=Sn(SO4)2+2H2O 增大 减小 4:1 1.5 否 Zn+2OH-=ZnO22-+H2↑ In3++3e-=In
【解析】
ITO靶材废料(主要由In2O3、SnO2组成)用H2SO4处理,In2O3与硫酸反应产生In2(SO4)3进入溶液,而SnO2有少量反应产生Sn(SO4)2进入溶液,大部分仍以固体形式存在,过滤后除去固体SnO2,向滤液中加入Zn粉,发生反应Sn4++2Zn=Sn+2Zn2+,将反应产生的Sn过滤除去,向滤液中加入Zn粉,发生置换反应:3Zn+2In3+=3Zn2++2In,由于Zn过量,所以过滤,除去滤液,得到的滤渣中含有Zn、In,向滤渣中加入NaOH溶液,发生反应:Zn+2NaOH=Na2ZnO2+H2↑,除去过量Zn单质,得到粗In,然后电解精炼得到精铟。
(1)通过图示可知:在x不变时,真空蒸馏法的相对初始速率较大,可能原因是蒸馏法得到的催化剂中杂质少纯度高,避免了杂质对催化剂催化作用的影响; 在同样条件下,x值越大,相对初始速率越大,说明In2O3的催化效果更好;
(2)①酸浸时In2O3、SnO2与硫酸发生反应,“浸出”反应主要发生:In2O3+3H2SO4=In2(SO4)3+3H2O,此外还发生了反应:SnO2+2H2SO4=Sn(SO4)2+2H2O;
(3)在Oa段发生反应:Sn4++2Zn=Sn+2Zn2+,n(Sn4+)=![]() n(Zn)=
n(Zn)=![]() ×0.02 mol=0.01 mol,在ab段发生反应:3Zn+2In3+=3Zn2++2In,n(In3+)=
×0.02 mol=0.01 mol,在ab段发生反应:3Zn+2In3+=3Zn2++2In,n(In3+)=![]() n(Zn)=
n(Zn)=![]() ×(0.08-0.02) mol=0.04 mol,溶液的体积相同,所以离子浓度比等于它们的物质的量的比,故c(In3+):c(Sn4+)=0.04:0.01=4:1;
×(0.08-0.02) mol=0.04 mol,溶液的体积相同,所以离子浓度比等于它们的物质的量的比,故c(In3+):c(Sn4+)=0.04:0.01=4:1;
(4)由于Ksp[Sn(OH)4]=1×10-56,Ksp[Sn(OH)4]=c(Sn4+)·c4(OH-)=1×10-56,c(Sn4+)=1×10-6mol/L,所以c(OH-)=10-12.5,则c(H+)= =10-1.5,所以此时溶液pH=1.5;由于Ksp[In(OH)3]= =1×10-33,In2(SO4)3的浓度为1 mol/L,则c(In3+)=2 mol/L,而c(OH-)=10-12.5 mol/L,c(In3+)·c3(OH-)=2×(10-12.5)3=2×10-37.5<1×10-33,因此此时In3+不能形成沉淀;
=10-1.5,所以此时溶液pH=1.5;由于Ksp[In(OH)3]= =1×10-33,In2(SO4)3的浓度为1 mol/L,则c(In3+)=2 mol/L,而c(OH-)=10-12.5 mol/L,c(In3+)·c3(OH-)=2×(10-12.5)3=2×10-37.5<1×10-33,因此此时In3+不能形成沉淀;
(5) “碱熔”时NaOH与Zn反应,主要反应的离子方程式为:Zn+2OH-=ZnO22-+H2↑;
(6)以粗铟为阳极,纯铟为阴极,H2SO4、NaCl和InCl3混合液为电解液可提纯粗铟。阳极上In失去电子变为In3+进入溶液,阴极上In3+得到电子变为In单质,阴极的电极方程式为:In3++3e-=In。

【题目】已知常温下,3种物质的电离平衡常数如下表:
物质 | HCOOH | CH3COOH | NH3·H2O |
电离平衡常数K | 1.77×104 | 1.75×105 | 1.76×105 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa
B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7