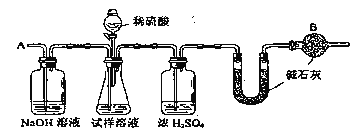
题目内容
【题目】下表为元素周期表的一部分,请回答有关问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
第2周期 | ① | ② | ||||||
第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素⑥的原子结构示意图___________;写出⑤的氧化物的一种用途__________。
(2)表中⑤和⑥气态氢化物的稳定性顺序为 ______ >______(填氢化物的化学式);
(3)表中能形成两性氢氧化物的元素是_________(填元素符号),该元素的单质与③的氢氧化物水溶液反应的离子反应方程式_______________。
【答案】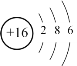 光导纤维 H2S SiH4 Al 2Al+2OH-+2H2O=2AlO2-+3H2↑
光导纤维 H2S SiH4 Al 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
根据8种元素在周期表中的位置,推出①为N,②为F,③为Na,④为Al,⑤为Si,⑥为S,⑦为Cl,⑧为Ar,然后利用元素周期律、元素及其化合物的性质等知识进行分析;
(1)⑥为S,其原子结构示意图为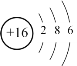 ,⑤为Si,其氧化物为SiO2,SiO2是光导纤维成分,即SiO2的用途可以制作光导纤维;
,⑤为Si,其氧化物为SiO2,SiO2是光导纤维成分,即SiO2的用途可以制作光导纤维;
(2)同周期从左向右非金属性增强,非金属性越强,其氢化物的稳定性越强,因此有H2S的稳定性强于SiH4;
(3)两性氢氧化物是Al(OH)3,即能形成两性氢氧化物的元素是Al;③的氢氧化物是NaOH,铝与NaOH反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。

练习册系列答案
相关题目
【题目】在四支试管中发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,生成气体的速率最大的是( )
试管 | 温度/℃ | 等质量的CaCO3的形状 | 盐酸浓度/mol.L-1 |
A | 20 | 块状 | 0.5 |
B | 20 | 块状 | 1.0 |
C | 40 | 块状 | 1.0 |
D | 40 | 粉末 | 1.0 |
A.AB.BC.CD.D