题目内容
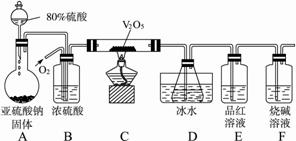
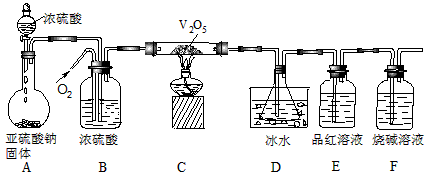
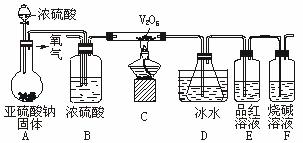
某校学生活动小组设计如下图所示实验装置探究工业制硫酸接触室中的反应产物,并测定此条件下二氧化硫的转化率。实验过程中,装置D中锥形瓶内产生白色沉淀,装置E中溶液褪色。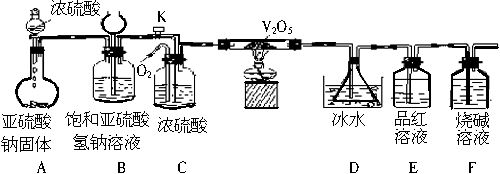
试回答下列问题:
(1)装置C有三个作用:①干燥SO2和O2;②使SO2与O2充分混合;③___________。
(2)装置D锥形瓶中盛放的液体可能是(选填序号)___________。
A.少量高锰酸钾溶液
B.少量小苏打溶液
C.少量氯化钡溶液
D.少量硝酸钡溶液
装置D中锥形瓶必须浸入冰水中的原因是___________。
(3)反应停止后,先关闭K,继续通入O2,其目的是___________。
(4)反应停止后,要通过装置D锥形瓶中产生白色沉淀的量,测定已被氧化的二氧化硫的量时,在滤出沉淀前必须进行的一步实验操作是(简述过程)___________。
(5)若从锥形瓶里得到的沉淀质量为mg,要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是(选填序号)________,二氧化硫的转化率是________(用含有m、a、b、c、d中的一个或几个字母的代数式来表示)。
① 装置F中增加的质量ag
② 装置A中亚硫酸钠减少的质量bg
③ 装置B中增加的质量cg
④ 装置E中增加的质量dg
(6) ①若(3)中通入O2的时间过长,则可能使检测得到的SO2的转化率________。
②若装置D中不用冰水浴,则可能使检测得到的SO2的转化率________。
③用酒精灯不停地加热,则可能使检测得到的SO2的转化率_______(填“偏大”、“偏小”或“不变”)。
(1)③便于通过观察产生气泡的速率,控制氧气和二氧化硫的比例
(2)C; SO3溶于水是放热反应,若不冷却,易形成酸雾,不利于SO3的吸收
(3)将装置中的SO2和SO3全部导入吸收剂中
(4)向锥形瓶中滴加氯化钡溶液,直至沉淀量不再增加(或静置后向上层清液中滴入氯化钡溶液,若产生沉淀,需继续加入氯化钡溶液,重复上述过程至清液中不再产生沉淀为止)
(5)①④;
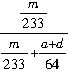 ×100%
×100% (6)①偏小 ②偏小 ③偏小
【试题分析】
(1)观察整个装置图,分析各个装置的作用。装置A的作用是制备SO2气体:Na2SO3 (s)+ H2SO4(浓)=Na2SO4 + SO2↑+ H2O。装置B可当储气瓶使用,当关闭K时,SO2进入B中,由于SO2不与饱和NaHSO3溶液反应,随着SO2不断增加,容器内的压强不断增大,液体被压入漏斗中;当打开K时,SO2进入装置C中。C中的浓硫酸除题述作用以外,还可以通过观察产生气泡的速率,控制氧气和二氧化硫的比例,因SO2转化为SO3的反应是可逆反应,可适当增加O2的用量来提高SO2的转化率。
(2)SO2与O2在V2O5的催化及加热条件下,在硬质玻管内发生了如下反应:2SO2 +O2
 2SO3,进入装置D内的气体主要有SO3、SO2和O2,且气体温度较高,通过装置D中的冰水浴冷却,从而使SO3与SO2和O2分离,由于SO3与H2O的反应是放热反应,若不用冰水浴冷却,易形成酸雾,不利于SO3的吸收。装置E中的品红溶液褪色是由于SO2的漂白性引起的,最后用烧碱吸收多余的SO2,防止其污染环境。装置D锥形瓶中只能选用BaCl2溶液,若选用KMnO4溶液,则SO2能被其氧化,后面看不到装置E中的品红溶液褪色,且使测量反应生成的SO3的含量偏大;若选用NaHCO3溶液,则要与生成的H2SO4反应使测量结果偏小;若选用Ba(NO3)2溶液,因有HNO3存在也能与SO2反应生成BaSO4沉淀,干扰SO2转化率的测定。
2SO3,进入装置D内的气体主要有SO3、SO2和O2,且气体温度较高,通过装置D中的冰水浴冷却,从而使SO3与SO2和O2分离,由于SO3与H2O的反应是放热反应,若不用冰水浴冷却,易形成酸雾,不利于SO3的吸收。装置E中的品红溶液褪色是由于SO2的漂白性引起的,最后用烧碱吸收多余的SO2,防止其污染环境。装置D锥形瓶中只能选用BaCl2溶液,若选用KMnO4溶液,则SO2能被其氧化,后面看不到装置E中的品红溶液褪色,且使测量反应生成的SO3的含量偏大;若选用NaHCO3溶液,则要与生成的H2SO4反应使测量结果偏小;若选用Ba(NO3)2溶液,因有HNO3存在也能与SO2反应生成BaSO4沉淀,干扰SO2转化率的测定。(3)反应需要测定SO2的转化率,为了使测定值准确,必须使装置内的SO2和SO3全部与吸收剂反应,故反应停止后,先关闭K,继续通入O2,其目的是将装置中的SO2和SO3全部导入吸收剂中。
(4)因为是通过测定BaSO4的质量求得SO2的转化率的,故必须保证SO42-与Ba2+充分反应生成沉淀。为此必须检验所加的BaCl2是否足量。
(5)要测SO2的转化率,必须知道SO2的总质量及已经转化的SO2的质量,其中已经转化的SO2的质量可通过BaSO4沉淀的量得到,SO2的总质量可由选项①④及BaSO4的质量得到。n(SO2)转化=n(BaSO4)=m/233 mol,n(SO2)总=[m/233 +(a +d)/64]mol,故SO2的转化率为
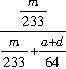 ×100% 。
×100% 。(6)若通入O2的时间过长,O2可能带走部分混合气体而使测定出的SO2转化率偏低;若不用冰水浴,部分SO3会转化为酸雾,使测定出的SO2的转化率偏低;因SO2转化为SO3的反应是放热反应,温度高不利于SO2的转化,故测定出SO2的转化率偏低。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目