题目内容
(12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
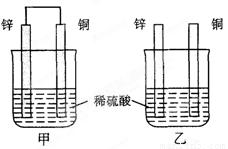
(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的c(H+)均增小
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________ mol·L-1。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________L。
(1)BD (2)甲>乙 (3)6.02×1022(0.1NA)
(4)1 (5)Zn-2e-=Zn2+; (6) 4.48
【解析】(1)根据装置特点可知,甲是原电池,锌比铜活泼,锌是负极,失去电子,铜是正极,溶液中的氢离子得到电子;乙不是原电池,锌能直接和稀硫酸发生置换反应,而铜不能和稀硫酸反应。所以正确的答案选BD。
(2)通过原电池反应进行的反应速率大于直接发生化学反应的反应速率。
(3)1.12L气体在标准状况下的物质的量是0.05mol,转移电子是0.05mol×2=0.1mol,数目是6.02×1022(0.1NA)。
(4)溶液中c(H+)=0.1 mol·L-1,所以氢离子的物质的量是0.1mol,因此剩余硫酸是0.05mol。消耗硫酸是0.05mol,所以原硫酸的物质的量是0.1mol,其浓度是0.1mol÷0.1L=1.0mol/L。
(5) 甲中锌是负极,发生的电极反应为Zn-2e-=Zn2+。
(6)电极减少的质量就是参加反应的锌的质量,即消耗锌是13g,物质的量是0.2mol,生成氢气是0.2mol,标准状况下的体积是4.48L。

(本题共12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的c(H+)均增小 |
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________。
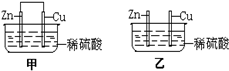 将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )
将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )
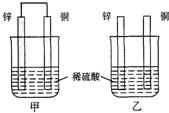 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题: