��Ŀ����
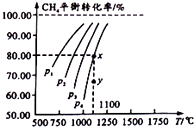
����Ŀ���״���һ�ֿ������������Դ��һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2 ��g��CH3OH��g����H=a kJmol��1 �� �����Ϊ2L���ܱ������г���2mol CO��4mol H2 �� ��ò�ͬ�¶������������������ʵ�����ʱ�䣨min���ı仯��ϵ��ͼ�Т�������ʾ�� 
��1�����жϷ�Ӧ�ﵽ��ѧƽ��״̬����������ĸ����
A.c��CO����c��H2���ı�ֵ���ֲ���
B.����������ѹǿ���ֲ���
C.�����������ܶȱ��ֲ���
D.��λʱ������1molCO���ĵ�ͬʱ��1mol CH3OH����
E.v����H2��=2v����CH3OH��
��2���٢�͢���ȣ���ı�ķ�Ӧ������ ��
�ڷ�Ӧ����9minʱ�ﵽƽ�⣬�ȽϷ�Ӧ����¶ȣ�T1���ͷ�Ӧ����¶ȣ�T3���ĸߵͣ�T1T3���������������=������������Ӧ����Ӧ������Ȼ����ȡ�����
��3���ٷ�Ӧ����6minʱ�ﵽƽ�⣬�ӷ�Ӧ��ʼ���ﵽƽ��ʱv ��CH3OH��=mol/��Lmin����
�ڷ�Ӧ����2minʱ�ﵽƽ�⣬������¶��µ�ƽ�ⳣ��K= �� ��������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1mol CO��3mol CH3OH��ƽ�⽫���������Ӧ���淴Ӧ�Ͳ��ƶ�������ԭ���� ��
���𰸡�
��1��BE
��2��ʹ�ô�������������
��3��0.125��12�����ƶ�����Ϊƽ������1molCO��3molCH3OH����ʱ 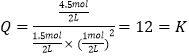 ������ƽ�ⲻ�ƶ�
������ƽ�ⲻ�ƶ�
���������⣺��1��A��c��CO����c��H2���ı�ֵ���ֲ���δ˵�����淴Ӧ������˵����Ӧ����ƽ�⣬�ʴ��� B���淴Ӧ���л���������ʵ�����С�����º�����ѹǿ��С��������ѹǿ���ֲ���˵������ƽ�⣬����ȷ�� C������������������䣬���º����£������������ܶ�ʼ�ձ��ֲ��䣬����˵����Ӧ����ƽ�⣬�ʴ��� D����λʱ������1molCO���ĵ�ͬʱ��1mol CH3OH����δ˵�����淴Ӧ������˵����Ӧ����ƽ�⣬�ʴ��� E��v����H2��=2v����CH3OH��˵�����淴Ӧ����������ȣ���˵����Ӧ����ƽ�⣬����ȷ����ѡBE����2���٢�͢���ȷ�Ӧ���ʼӿ죬��Ӱ��ƽ���ƶ�������ӦΪ�������ʵ�����С�ķ�Ӧ��Ӧ��ʹ�ô��������Դ��ǣ�ʹ�ô������ڷ�Ӧ���ƽ��ʱ���õ�ʱ��ȷ�Ӧ���ƽ��ʱ���õ�ʱ�䳤����ѧ��Ӧ�������������¶Ƚϵͣ���T1��T3 �� �����¶ȣ�����������ʵ������ӣ����������ƶ������Է�Ӧ�Ƿ��ȵģ����Դ��ǣ����� ���ȣ���3���ٷ�Ӧ����6minʱ�ﵽƽ�⣬�ӷ�Ӧ��ʼ���ﵽƽ��ʱv ��CH3OH��=mol/��Lmin����
CO��g��+ | 2H2 ��g�� | CH3OH��g�� | ��H=a kJmol��1 | |
��ʼ�� | 2mol | 4mol | 0 | |
�仯�� | x | 2x | x | |
ƽ���� | 2-x | 4-2x | x |
��2��x+4��2x+x=3�����x=1.5������v ��CH3OH��= ![]() mol/��Lmin��=0.125 mol/��L��min����
mol/��Lmin��=0.125 mol/��L��min����
���Դ��ǣ�0.125���ڢ��¶���ͬ��ƽ�ⳣ����ͬ��ƽ�ⳣ��K����= ![]() =
= 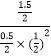 =12����ʱŨ����Qc=
=12����ʱŨ����Qc= 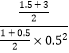 =12=K����ƽ�ⲻ�ƶ���
=12=K����ƽ�ⲻ�ƶ���
���Դ��ǣ�12�����ƶ��� ��Ϊƽ������1molCO��3molCH3OH����ʱ 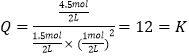 ������ƽ�ⲻ�ƶ���
������ƽ�ⲻ�ƶ���
�����㾫����������Ҫ�����˻�ѧƽ��״̬���ʼ������ͻ�ѧƽ��״̬���жϵ����֪ʶ�㣬��Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���Ȳ�����ȷ�����⣮