题目内容
【题目】下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
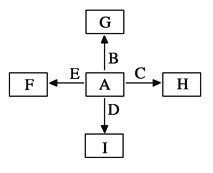
已知:①G为红棕色固体,能发生反应C+G![]() B+H,该反应会放出
B+H,该反应会放出
大量的热②I是一种常见的温室气体,它和E可以发生反应:
2E+I![]() 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题:
(1)①中反应的化学方程式为_____________________;
(2)化合物I的电子式为___________,它的空间构型是________________;
(3)8.0g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量____________g;
(4)C与过量NaOH溶液反应后溶液与过量化合物I反应的离子方程式为_____________;
(5)E在I中燃烧观察到的现象是_________________。
【答案】(1)2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
(2)![]() 直线形
直线形
(3)3.2 (4)AlO2—+CO2+2H2O=Al(OH)3↓+HCO3-
剧烈燃烧,发出耀眼的白光,有白色固体生成(注:白色固体不写不给分)
【解析】
试题分析:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知G为红棕色固体,能发生反应C+G![]() B+H,该反应会放出大量的热,所以G是氧化铁,C是Al,B是Fe,H水解氧化铝,则A是氧气;I是一种常见的温室气体,则I是二氧化碳,因此D是碳,它和E可以发生反应:2E+I
B+H,该反应会放出大量的热,所以G是氧化铁,C是Al,B是Fe,H水解氧化铝,则A是氧气;I是一种常见的温室气体,则I是二氧化碳,因此D是碳,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。所以E是镁,F是氧化镁。
2F+D,F中E元素的质量分数为60%。所以E是镁,F是氧化镁。
(1)根据以上分析可知①中反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(2)化合物二氧化碳的电子式为![]() ,它的空间构型是直线形;
,它的空间构型是直线形;
(3)8.0g 氧化铁是0.05mol,溶于盐酸得到0.1mol铁离子,与铜粉完全反应,根据方程式2Fe3++Cu=2Fe2++Cu2+可知至少所需铜粉的质量为0.05mol×64g/mol=3.2g;
(4)C与过量NaOH溶液反应后溶液是偏铝酸钠,与过量化合物二氧化碳反应的离子方程式为AlO2—+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)镁在二氧化碳中燃烧生成氧化镁和碳,则E在I中燃烧观察到的现象是剧烈燃烧,发出耀眼的白光,有白色固体生成。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案