题目内容
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
A | A原子核外电子有6种不同的运动状态 |
B | B元素的第一电离能比同周期相邻两个元素都大 |
C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
D | D原子最外层电子数等于电子层数 |
E | E的基态原子最外层电子排布式为3s23p2 |
F | F与C位于不同周期,F原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)F基态原子核外价电子排布式是________________
(2)A、B、E三种元素电负性由大到小排列顺序为__________________
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为________________

(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g) ![]() B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式__________________
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度______g·cm-3(不必计算出结果)。
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式_______________
(8)某学生所做的有关F元素的实验流程如下图:
F单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:___________________
【答案】 3d104s1 N>C>Si sp2杂化 CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ/mol ![]() 30 H2O2+2e- + 2H+ = 2H2O [Cu (NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
30 H2O2+2e- + 2H+ = 2H2O [Cu (NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
【解析】A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加,C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色,则C为Na;A原子核外电子有6种不同的运动状态,A为碳元素;B的原子序数介于碳、氧之间,则B为N元素;E的基态原子最外层电子排布式为3s23p2,则E为Si;D原子最外层电子数等于电子层数,原子序数介于E和C之间,则D是Al;F与C位于不同周期,F处于第四周期,F原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则F为Cu。
(1)铜原子的基态原子核外价电子排布式是3d104s1;(2)非金属性越强,电负性越大,则A、B、E三种元素电负性由大到小排列顺序为N>C>Si;(3)根据结构可知类似于石墨的的层状结构,则N原子的杂化类型为sp2杂化。(4)已知:①、CH4(g)+2 NO2(g)= N2(g)+CO2(g)+2H2O (g) △H1=-867kJ/mol,②、2NO2(g)N2O4(g)△H2=-56.9kJ/mol,由盖斯定律,①-②得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ/mol;(5)Al单质为面心立方晶体,晶胞中含有铝原子的个数是4,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,则其单质的密度为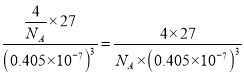 g·cm-3。(6)Si60分子中每个Si原子只跟相邻的3个原子形成共价键,且每个Si原子最外层都满足8电子稳定结构,则每个Si形成的这3个键中,必然有1个双键,这样每个Si原子最外层才满足8电子稳定结构,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30;(7)原电池中负极发生失去电子的氧化反应,则铜是负极,正极是双氧水得到电子,电极反应式为H2O2+2e- + 2H+ = 2H2O。(8)蓝色溶液是铜离子和氨水形成的络离子,铜离子具有氧化性,则第⑤步反应的离子方程式为[Cu (NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3·H2O。
g·cm-3。(6)Si60分子中每个Si原子只跟相邻的3个原子形成共价键,且每个Si原子最外层都满足8电子稳定结构,则每个Si形成的这3个键中,必然有1个双键,这样每个Si原子最外层才满足8电子稳定结构,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30;(7)原电池中负极发生失去电子的氧化反应,则铜是负极,正极是双氧水得到电子,电极反应式为H2O2+2e- + 2H+ = 2H2O。(8)蓝色溶液是铜离子和氨水形成的络离子,铜离子具有氧化性,则第⑤步反应的离子方程式为[Cu (NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3·H2O。

【题目】已知下列数据:
物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:

①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3 min~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)反应中浓硫酸的作用是______________________________________;
写出制取乙酸乙酯的化学方程式:_____________________________。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是___________________;
步骤③所观察到的现象是_____________________________________;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应从仪器________(填“下口放”或“上口倒”)出。
