题目内容
等质量的钠进行下列实验,其中生成氢气最多的是
A.将钠投入到足量水中 B.将钠用铝箔包好并刺一些小孔,再放入足量的水中
C.将钠放入足量稀硫酸中 D.将钠放入足量稀盐酸中
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示 :
:
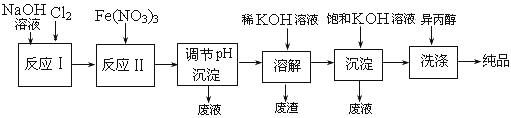
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应Ⅱ的离子方程式为 。
③高铁酸钾在水中技能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 ,它能净水的原因是因为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
已知反应 Fe(s) + CO2(g)  FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.4 |
(1)若500℃时进行反应①,CO2的起始浓度为2mol﹒L-1,CO的平衡浓度为__________。
(2)该反应为__________(选填“吸热”或“放热”)反应。
(3)700℃时反应达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.CO2 C.升高温度到900℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合该反应的是__________(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。



 C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是
C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是
 Ni(CO)4(g),△
Ni(CO)4(g),△ H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是