题目内容
下列叙述正确的是
| A.从海水中提取物质都必须通过化学反应才能实现 |
| B.将盛满二氧化氮气体的试管倒立在水中,可观察到溶液充满试管 |
| C.金属镁着火可用CO2灭火 |
| D.向 FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色 |
D
解析试题分析:海水淡化利用的是物理变化。错误。B. NO2和水发生化学反应: 3NO2+ H2O == 2HNO3+ NO。由于产物有NO气体,所以将盛满二氧化氮气体的试管倒立在水中,可观察到溶液充满试管的2/3.错误。C.Mg在二氧化碳中燃烧发生反应:2Mg+CO2  2MgO+C.故金属镁着火不可用CO2灭火。错误。 D.向 FeSO4溶液中滴加NaOH溶液,发生反应:FeSO4+2NaOH= Fe(OH)2↓+Na2SO4;4Fe(OH)2 + O2+2H2O == 4Fe(OH)3 。现象为先出现白色沉淀,最终沉淀转化成红褐色。正确。
2MgO+C.故金属镁着火不可用CO2灭火。错误。 D.向 FeSO4溶液中滴加NaOH溶液,发生反应:FeSO4+2NaOH= Fe(OH)2↓+Na2SO4;4Fe(OH)2 + O2+2H2O == 4Fe(OH)3 。现象为先出现白色沉淀,最终沉淀转化成红褐色。正确。
考点:考查海水及NO2、CO2、FeSO4的性质及应用的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
以下进行性质比较的实验,不合理的是
| A.比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液 |
| B.比较氯、溴非金属性:溴化钠溶液中通入氯气 |
| C.比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
下列叙述不正确的是
| A.含金属元素的离子一定是阳离子 |
| B.应用蒸馏的方法,可以分离沸点相差较大的液体混合物 |
| C.氯水和过氧化钠都具有漂白作用,其漂白原理相似 |
| D.高炉炼铁时,还原铁矿石的还原剂为一氧化碳 |
科学的假设与猜想是科学探究的先导和价值所在。在下列假设或猜想引导下的探究肯定
没有意义的是
| A.探究SO2和Na2O2可能化合生成Na2SO4 |
| B.探究NO和N2O3可能化合生成NO2 |
| C.探究NO2可能被NaOH溶液完全吸收生成NaNO2和NaNO3 |
| D.探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白 |
下列物质间的转化在给定条件下能实现的是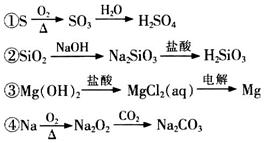
| A.②④ | B.③④ | C.①④ | D.①② |
下列由相关实验现象所推断出的结论中,正确的是
| A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B.加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少,说明二者均发生升华 |
| C.Fe与稀HNO3溶液、稀H2SO4溶液反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
下列推断正确的是( )
| A.SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.二氧化硫有漂白性,通入少量紫色石蕊试液中,充分振荡后溶液褪色 |
下列有关化学反应过程或实验现象的结论中,正确的是( )。
| A.NH3的水溶液可以导电,说明NH3是电解质 |
| B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si |
| C.在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液,溶液褪色,说明CaCl2 溶液显酸性 |
| D.向淀粉碘化钾溶液中加入溴水,溶液变为蓝色,说明Br2的氧化性强于I2 |