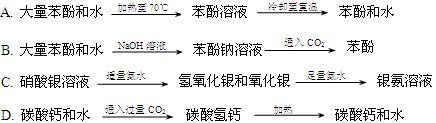
题目内容
下列叙述不正确的是
| A.含金属元素的离子一定是阳离子 |
| B.应用蒸馏的方法,可以分离沸点相差较大的液体混合物 |
| C.氯水和过氧化钠都具有漂白作用,其漂白原理相似 |
| D.高炉炼铁时,还原铁矿石的还原剂为一氧化碳 |
A
解析试题分析:A.如MnO4-、AlO2-都含有金属元素,但是为阴离子。错误。B对于互溶的沸点相差较大的液体混合物可以应用蒸馏的方法进行分离。正确。C.氯水中含有的次氯酸及过氧化钠都具有漂白作用,其漂白原理相似,都是氧化漂白。正确。D. 高炉炼铁时反应原理为:3CO+Fe2O3 2Fe+3CO2。还原剂为CO。正确。
2Fe+3CO2。还原剂为CO。正确。
考点:考查金属元素构成的离子、氯水和过氧化钠的漂白原理、高炉炼铁反应原理及分离混合物的方法等。

练习册系列答案
相关题目
下列有关物质的性质、应用等的说法中正确的是
| A.浓硫酸久置于空气中体积不会变化 |
| B.二氧化硫具有漂白性,与氯水混合使用效果更好 |
| C.合金的熔点可以低于它的成分金属 |
| D.Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
对以下反应的产物判断正确的是
| A.H2S与湿的醋酸铅试纸:生成硫化铅和醋酸 |
| B.SO2与氨水:生成的铵盐肯定只有一种 |
| C.CO2与NaClO溶液:生成的钠盐肯定只有一种 |
| D.NO2、NO与NaOH溶液:生成的钠盐肯定只存一种 |
下列有关物质的性质与应用不对应的是
| A.氨气具有还原性,可用作制冷剂 |
| B.MgO、Al2O3熔点高,可用于制作耐火材料 |
| C.Na2CO3溶液显碱性,可用其热溶液除去金属餐具表面油污 |
| D.常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
某课外实验小组设计的下列实验不合理的是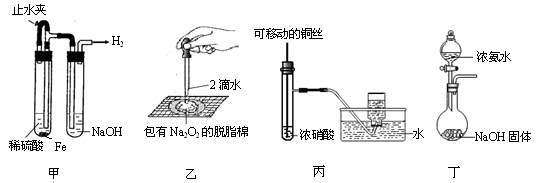
| A.甲可用于制备并观察氢氧化亚铁沉淀 |
| B.乙可用于证明过氧化钠与水反应放热 |
| C.丙可用于制备并收集少量NO2气体 |
| D.丁可用于实验室制备少量氨气 |
下列叙述正确的是
| A.从海水中提取物质都必须通过化学反应才能实现 |
| B.将盛满二氧化氮气体的试管倒立在水中,可观察到溶液充满试管 |
| C.金属镁着火可用CO2灭火 |
| D.向 FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色 |
下列陈述Ⅰ、Ⅱ均正确且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | FeCl3溶液可溶解废旧电路板中的铜 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | NH3有还原性 | NH3可用H2SO4吸收 |
| D | 浓HNO3有酸性 | 浓HNO3不可用铁制容器盛放 |