题目内容
下列说法正确的是( )
A.P和S属于第三周期元素,P原子半径比S小
B.同周期ⅡA和ⅢA族元素的原子序数都相差1
C.短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则原子序数、原子半径和单质的还原性都按照A、B、C、D的顺序减小
D.Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4强
D
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是
| A.比较这两种元素的单质的密度和熔点 |
| B.在氯化铝和氯化镁的溶液中分别滴加过量的氨水 |
| C.将空气中久置的镁带和铝片分别置于热水中,并滴入酚酞溶液 |
| D.用pH计分别测量相同物质的量浓度的氯化铝溶液和氯化镁溶液的pH |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是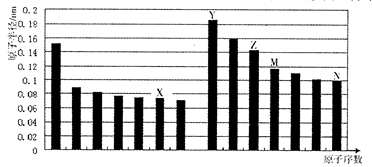
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的稳定性相比,前者较弱 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
| A.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 |
| B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C.第ⅠA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 |
| D.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新 |
下列有关化学用语表示正确的是( )
| A.对硝基甲苯的结构简式:O2NCH3 |
B.镁离子的结构示意图: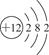 |
| C.次氯酸的电子式:H∶Cl?,?∶O?,?∶ |
D.亚硫酸钠水解的离子方程式:SO32—+2H2O H2SO3+2OH- H2SO3+2OH- |
依据元素周期表及元素周期律,下列推断正确的是( )
| A.同周期主族元素的原子形成的简单离子电子层结构相同 |
| B.C比Si的原子半径小,CH4的稳定性比SiH4弱 |
| C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱 |
| D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料 |
以下有关原子结构及元素周期律的叙述正确的是( )
| A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |
下列说法不正确的是( )
| A.多孔碳可用作氢氧燃料电池的电极材料 |
| B.pH计不能用于酸碱中和滴定终点的判断 |
| C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素 |
D.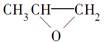 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物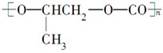 ,该反应符合绿色化学原则 ,该反应符合绿色化学原则 |
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,其中只有Z是金属元素,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法中正确的是 ( )。
| | X | | Y | |
| | | | W | |
A.X、Z、W、Q四种元素的最高价氧化物所对应的水化物均不可能呈现出酸性
B.Y的简单阴离子比W的简单阴离子的还原性弱
C.X、W、Q的氢化物均可在Y的单质中燃烧
D.Q的非金属性弱于W的非金属性