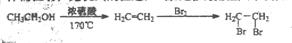题目内容
在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2中(a、b、c、d、e、f是各物质的化学计量数),若0.3molH2O被氧化,则被水还原的BrF3的物质的量是( )
| A.0.15mol | B.0.2mol | C.0.3mol | D.0.4mol |
在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为-1价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用.若0.3molH2O被氧化,氧原子提供电子物质的量为0.3mol×2,令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则:
0.3mol×2=xmol×[3-(-1)]
解得x=0.15
故选:A.
0.3mol×2=xmol×[3-(-1)]
解得x=0.15
故选:A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
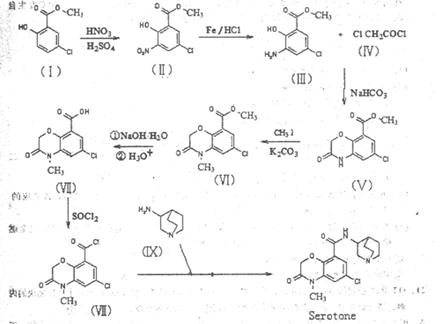
 Ⅴ中NaHCO3gm V
Ⅴ中NaHCO3gm V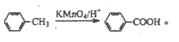
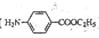 )的合成路线流程图(必要条件需注明,无机试剂任选)。合成路线流程图示例如下:
)的合成路线流程图(必要条件需注明,无机试剂任选)。合成路线流程图示例如下: