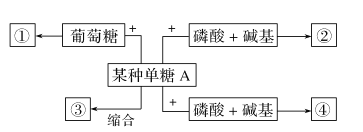
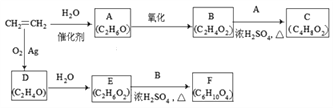
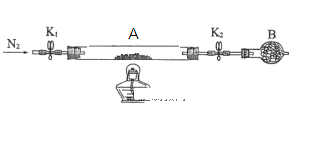
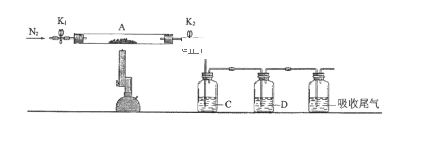
题目内容
【题目】X、Y、Z、W四种元素在元素周期表中序数逐渐增大。X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z的元素符号分别是:______、_______、________。
(2)画出Z的离子结构示意图__________。
(3)X、Y、Z的简单离子半径大小顺序为________________________________。
(4)用电子式表示W与Z形成化合物W2Z的过程____________________________。
(5)由X、Y、Z所形成的离子化合物是__________,它与W的最高价氧化物对应水化物的溶液加热时反应的离子方程式是________________________________。
【答案】H N O 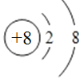 N3->O2->H+
N3->O2->H+ 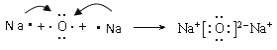 NH4NO3 OH-+NH4+
NH4NO3 OH-+NH4+![]() H2O+NH3↑
H2O+NH3↑
【解析】
X、Y、Z、W四种元素在元素周期表中序数逐渐增大,Y的氢化物分子中有3个共价键,则Y是N或P。Z原子最外层电子数是次外层电子数的3倍,则Z是O,Y、Z为同周期的相邻元素,所以Y是N。W原子的质子数等于Y、Z原子最外层电子数之和,因此W是Na。X为非金属元素,且X、W同主族,则X是H,据此解答。
(1)根据以上分析可知X、Y、Z的元素符号分别是H、N、O。
(2)氧元素的原子序数是8,则O的离子结构示意图为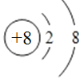 。
。
(3)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则X、Y、Z的简单离子半径大小顺序为N3->O2->H+。
(4)氧化钠是离子化合物,则用电子式表示W与Z形成化合物W2Z的过程为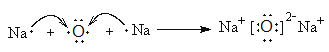 。
。
(5)由X、Y、Z所形成的离子化合物是硝酸铵,它与W的最高价氧化物对应水化物氢氧化钠的溶液加热时反应的离子方程式是OH-+NH4+![]() H2O+NH3↑。
H2O+NH3↑。

 阅读快车系列答案
阅读快车系列答案