题目内容
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强(提示:Na2S +2HCl = 2NaCl+ H2S↑),某化学实验小组设计了如下实验,请回答下列问题:

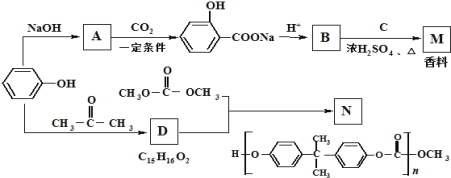
(1)画出虚线框内的实验装置图____,所加试剂为___________,该装置的作用是__________。
(2)装置B中盛放的试剂是____(填序号),
A.Na2S溶液B.Na2SO3溶液C.Na2SO4溶液
B装置中发生反应的离子方程式为___________________________。
(3)已知:①硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。②高氯酸的酸性比硫酸强;③铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;④HCl比H2S稳定;⑤硫酸比次氯酸稳定;能说明氯的非金属性比硫强的是____(填序号)。
A.全部 B. ①②③④ C.①②④⑤ D. ①③④⑤
(4)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________________。
【答案】 饱和食盐水 除去Cl2中的HCl气体 A S2-+Cl2 = 2Cl-+S↓ B Cl2+2OH- = Cl-+ClO-+H2O
饱和食盐水 除去Cl2中的HCl气体 A S2-+Cl2 = 2Cl-+S↓ B Cl2+2OH- = Cl-+ClO-+H2O
【解析】
(1)氯气在饱和食盐水中溶解度很小,HCl易溶于水;
(2)从置换反应判断元素非金属性强弱分析,氯气能把硫元素从其硫化钠溶液中置换出来;
(3)依据元素周期律作答;
(4)氯气为有毒气体,要进行尾气处理。
(1)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度,所用装置为: ;所加试剂为饱和食盐水;装置的作用为:除去Cl2中的HCl气体;
;所加试剂为饱和食盐水;装置的作用为:除去Cl2中的HCl气体;
(2)要在B中发生氯气置换出硫的反应,结合已知信息在给定试剂中只能选取Na2S溶液,故A项正确;发生的是置换反应,其离子方程式为:S2-+Cl2 = 2Cl-+S↓;
(3)①硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子,则氯原子得电子能力强,即非金属性较硫强,①项正确;
②最高价氧化物对应水化物的酸的酸性越强,则元素非金属性越强,②项正确;
③单质将同样的金属氧化到的价态越高则原子的得电子能力强,③项正确;
④元素的氢化物的稳定性越强则原子的得电子能力越强,④项正确;
⑤硫酸比次氯酸稳定,不能说明非金属性强弱,⑤项错误;
综上所述,①②③④项正确,答案选B。
(4)实验时,用氢氧化钠对氯气进行尾气处理,反应的原理方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O。