题目内容
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)2NO(g) + O2(g),(正反应吸热),实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)c(O2),k正、k逆为速率常数,受温度影响,下列说法正确的是( )
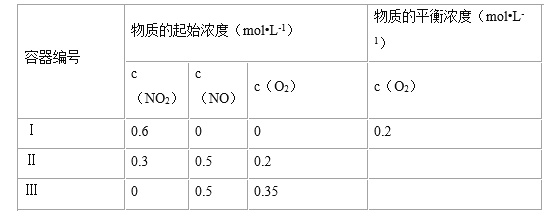
A.设K为该反应的化学平衡常数,则有K=k逆/k正
B.容器Ⅱ中起始反应正向进行最终达到平衡
C.达到平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若T2>T1,则k逆/k正>1.25
【答案】B
【解析】
A.设K为该反应的化学平衡常数,v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)c(O2),![]() ,则有
,则有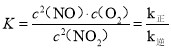 ,故A错误;
,故A错误;
B.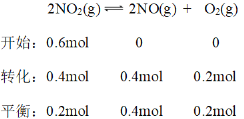
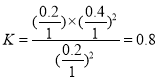 ,容器Ⅱ中起始反应时,
,容器Ⅱ中起始反应时,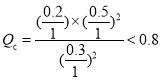 ,反应正向进行最终达到平衡,故B正确;
,反应正向进行最终达到平衡,故B正确;
C.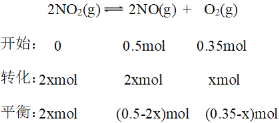
达到平衡时,当NO的体积分数等于50%,![]() ,解得x=0.05mol,得出
,解得x=0.05mol,得出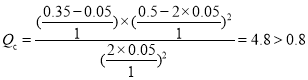 ,因此平衡逆向移动,容器Ⅲ中NO的体积分数小于50%,故C错误;
,因此平衡逆向移动,容器Ⅲ中NO的体积分数小于50%,故C错误;
D.当温度改变为T1时,则![]() ,当温度改变为T2时,若T2>T1,平衡正向移动,K变大,则
,当温度改变为T2时,若T2>T1,平衡正向移动,K变大,则![]() ,故D错误。
,故D错误。
综上所述,答案为D。

练习册系列答案
相关题目