题目内容
【题目】下列说法正确的是
①6.02×1023个分子的体积约是22.4 L ②0.5 mol H2的体积为11.2 L ③标准状况下,1 mol H2O的体积为22.4 L ④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L ⑤各种气体的气体摩尔体积都约为22.4 L·mol-1 ⑥标准状况下,体积相同的气体所含的分子数相同
A. ①③⑤B. ④⑥C. ③④⑥D. ②④⑥
【答案】B
【解析】
①此物质不一定为气体,若为气体也没有指明是标准状况,则6.02×1023个分子的物质的量为1mol,所占的体积不一定是22.4L,故①错误;
②不一定在标准状况下,则Vm未知,无法确定0.5 mol H2的体积,故②错误;
③标准状况下,水不是气态,则不能根据气体的摩尔体积计算1mol水的体积,故③错误;
④CO与N2的摩尔质量均为28g/mol,标准状况下,28gCO与N2的混合气体的体积约为![]() ×22.4L/mol=22.4L,故④正确;
×22.4L/mol=22.4L,故④正确;
⑤气体摩尔体积与温度、压强有关,则状态未知,不能确定气体的摩尔体积,标准状况下各种气体的气体摩尔体积都约为22.4Lmol-1,故⑤错误;
⑥标准状况下,体积相同的气体,物质的量相同,由n=![]() 可知,分子数相同,故⑥正确;
可知,分子数相同,故⑥正确;
故答案为B。

【题目】工业上采用氯化铵熔烧菱锰矿制备高纯碳酸锰的流程如图所示:
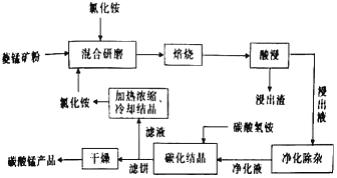
已知:①菱锰矿的主要成分是MnCO3,其余为Fe、Ca、Mg、Al等元素。②部分阳离子沉淀时溶液的pH;
离子 | Al3+ | Fe3+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的pH | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
③焙烧过程中主要反应为MnCO3+2NH4C1![]() MCl2+2NH3↑+CO2↑+H2O
MCl2+2NH3↑+CO2↑+H2O
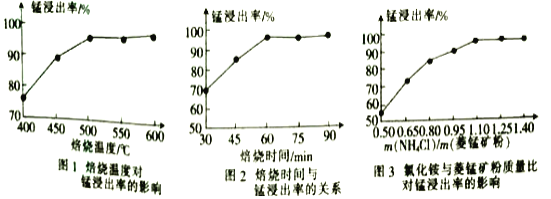
(1)合1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、c(NH4C1)/c(菱锰矿粉)分别为______、______、______。
(2)对浸出液净化除杂时,需先加入MnO2,作用是______,再调节溶液pH的最大范围为______,将Fe3+和Al3+变为沉淀面除去,然后加人NH4F将Ca2+、Mg2+变为氧化物沉淀除去。
(3)”碳化结品”步骤中,加入碳酸氢铵时反应的离子方程式为______。
(4)上述流程中可循环使用的物质是______(填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnO2完全转化为[Mn(PO4)2]3-(其中NO3-转化为NO2-);加入稍过量的硫酸,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00mL0.500molL-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00mL0.500molL-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为______。
②试样中锰的质量分数为______。