题目内容
【题目】已知某温度下CH3COOH的电离常数K=1.6×10-5,该温度下向20 mL 0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题:
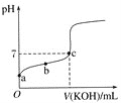
(1)a点溶液中c(H+)为____mol·L-1。
(2)b点溶液中溶质__,CH3COOH的电离常数___1.6×10-5(“>”、“<”或“=”)。
【答案】4×10-4 CH3COOH、CH3COOK =
【解析】
(1)根据醋酸电离平衡常数Ka=![]() ,计算0.01 mol·L-1CH3COOH溶液的中氢离子浓度;
,计算0.01 mol·L-1CH3COOH溶液的中氢离子浓度;
(2)醋酸钠是强碱弱酸盐,根据醋酸钠溶液的pH大于7判断b点的溶质;电离平衡常数只与温度有关。
(1)Ka=![]() ,c(H+)=
,c(H+)=![]() =
=![]() mol·L-1=4×10-4mol·L-1。
mol·L-1=4×10-4mol·L-1。
(2)醋酸钠溶液的pH大于7,b点是在醋酸中加入一定量KOH溶液,b溶液呈酸性,溶液中有二者反应生成CH3COOK,还一定有剩余的醋酸;电离平衡常数只与温度有关,温度不变,电离常数不变,b点溶液中CH3COOH的电离常数=1.6×10-5。

练习册系列答案
相关题目