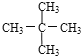
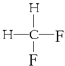
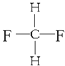
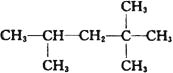
题目内容
【题目】【无机工业流程】

实验室从含碘废液(除H2O外,含有CCl4、I2、I- 等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程为 ;该操作将I2还原为I- 的目的是 。
(2)操作X的名称为____________。

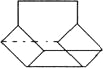
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO![]() +2IO
+2IO![]() +2H+===I2+5SO
+2H+===I2+5SO![]() +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO![]() 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO![]() 的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
【答案】(1)SO32-+I2+H2O=2I-+SO42-+2H+,使四氯化碳中碘进入水层
(2)分液(3)使氯气在溶液中有较大的溶解度 氢氧化钠溶液
(4)从水层取少量的溶液,加入1—2mL淀粉溶液,加热盐酸酸化,滴加氯化铁溶液,若溶液变蓝,说明废水中含有碘离子;若溶液不变蓝,说明废水中不含有碘离子。另从水层取少量溶液,加入1—2mL淀粉溶液,加热盐酸酸化,滴加亚硫酸钠溶液,若溶液变蓝,说明废水中含有碘酸根离子,否则不含有。
【解析】试题分析:(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,亚硫酸根离子被氧化为硫酸根离子,离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+;碘易溶于有机溶剂,碘离子易溶与水,所以把碘单质转化为碘离子的目的是使四氯化碳中碘进入水层。
(2)四氯化碳不溶于水,所以溶液分层,则用分液的方法除去四氯化碳。
(3)气体的溶解度随温度升高而降低,低温使氯气在溶液中有较大的溶解度;氯气有毒会污染空气,应用碱溶液吸收,即锥形瓶里盛放的溶液为NaOH溶液。
(4)需要检验碘离子和碘酸根离子,两种离子均应转化为碘单质用淀粉检验,前者需氧化剂,后者需还原剂,根据题意,具体操作为从水层取少量的溶液,加入1—2mL淀粉溶液,加热盐酸酸化,滴加氯化铁溶液,若溶液变蓝,说明废水中含有碘离子;若溶液不变蓝,说明废水中不含有碘离子。另从水层取少量溶液,加入1—2mL淀粉溶液,加热盐酸酸化,滴加亚硫酸钠溶液,若溶液变蓝,说明废水中含有碘酸根离子,否则不含有。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如下表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是 ,X的气态氢化物的电子式是 。
(2)Z元素在周期表中的位置是第 周期,第 族。Z和W形成的化合物属于 化合物(填“离子”或“共价”)。
(3)X、Y、Z、W的原子半径从大到小的顺序是 。
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: 。
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: 。
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: 。