题目内容
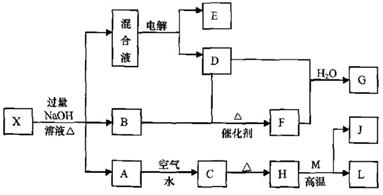
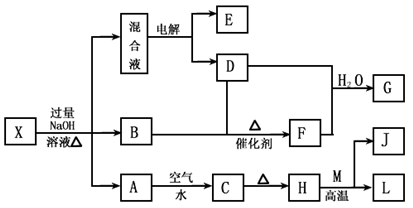
有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略).其中,B、D、E、F均为无色气体,W、K为日常生活中常见的两种金属单质,其中K的组成元素的原子序数是W的组成元素的原子序数的2倍,H和W反应可放出大量的热.在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,
请回答下列问题:
(1)检验B气体常用
(2)电解混合液时能产生O2:的阳极反应式为
(3)按要求写出上述转化关系中有关反应的化学方程式:
①含有K元素的化合反应:
②含有K元素的置换反应:
(4)K与过量G的稀溶液反应的离子方程式为
(5)物质X可能的化学式为

请回答下列问题:
(1)检验B气体常用
蘸有浓盐酸的玻璃棒检验
蘸有浓盐酸的玻璃棒检验
.(2)电解混合液时能产生O2:的阳极反应式为
4OH--4e-
O2↑+2H2O
| ||
4OH--4e-
O2↑+2H2O
.
| ||
(3)按要求写出上述转化关系中有关反应的化学方程式:
①含有K元素的化合反应:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.②含有K元素的置换反应:
Fe2O3+2Al
2Fe+A12O3
| ||
Fe2O3+2Al
2Fe+A12O3
.
| ||
(4)K与过量G的稀溶液反应的离子方程式为
Fe+4H++NO3-=Fe3++NO↑+2H2O
Fe+4H++NO3-=Fe3++NO↑+2H2O
.(5)物质X可能的化学式为
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
.分析:有一化合物X,其水溶液为浅绿色,说明X含有亚铁离子,W、K为日常生活中常见的两种金属单质,其中K的组成元素的原子序数是W的组成元素的原子序数的2倍,所以K是铁,W是铝,H和W发生铝热反应,根据元素守恒知,H是Fe2O3,J是A12O3,亚铁离子和氢氧根离子反应生成Fe(OH)3沉淀,Fe(OH)2被氧化生成Fe(OH)3,加热时,Fe(OH)3分解生成Fe2O3,所以A是Fe(OH)2,C是Fe(OH)3;
在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明混合溶液中含有硫酸根离子,混合溶液中还含有钠离子,所以电解混合溶液时,阴阳极上分别生成氢气、氧气,无色气体B和无色气体D生成无色气体F,且F能和D反应,则D是氧气,E是氢气,加热时,X能和氢氧化钠溶液反应生成气体,则X中含有铵根离子,所以B是NH3,则F是NO,NO、氧气和水反应生成HNO3.由此可知X为(NH4)2Fe(SO4)2,A为Fe(OH)2,B为NH3,C为Fe(OH)3,D为O2,E为H2,F为NO,G为HNO3,H为Fe2O3,J为A12O3,K为Fe,W为Al,结合对应物质的性质以及题目要求解答该题.
在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明混合溶液中含有硫酸根离子,混合溶液中还含有钠离子,所以电解混合溶液时,阴阳极上分别生成氢气、氧气,无色气体B和无色气体D生成无色气体F,且F能和D反应,则D是氧气,E是氢气,加热时,X能和氢氧化钠溶液反应生成气体,则X中含有铵根离子,所以B是NH3,则F是NO,NO、氧气和水反应生成HNO3.由此可知X为(NH4)2Fe(SO4)2,A为Fe(OH)2,B为NH3,C为Fe(OH)3,D为O2,E为H2,F为NO,G为HNO3,H为Fe2O3,J为A12O3,K为Fe,W为Al,结合对应物质的性质以及题目要求解答该题.
解答:解:有一化合物X,其水溶液为浅绿色,说明X含有亚铁离子,W、K为日常生活中常见的两种金属单质,其中K的组成元素的原子序数是W的组成元素的原子序数的2倍,所以K是铁,W是铝,H和W发生铝热反应,根据元素守恒知,H是Fe2O3,J是A12O3,亚铁离子和氢氧根离子反应生成Fe(OH)3沉淀,Fe(OH)2被氧化生成Fe(OH)3,加热时,Fe(OH)3分解生成Fe2O3,所以A是Fe(OH)2,C是Fe(OH)3;在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明混合溶液中含有硫酸根离子,混合溶液中还含有钠离子,所以电解混合溶液时,阴阳极上分别生成氢气、氧气,无色气体B和无色气体D生成无色气体F,且F能和D反应,则D是氧气,E是氢气,加热时,X能和氢氧化钠溶液反应生成气体,则X中含有铵根离子,所以B是NH3,则F是NO,NO、氧气和水反应生成HNO3.
由此可知X为(NH4)2Fe(SO4)2,A为Fe(OH)2,B为NH3,C为Fe(OH)3,D为O2,E为H2,F为NO,G为HNO3,H为Fe2O3,J为A12O3,K为Fe,W为Al,
(1)B为NH3,实验室常用蘸有浓盐酸的玻璃棒检验,可观察到浓烟生成,故答案为:蘸有浓盐酸的玻璃棒检验;
(2)混合液为硫酸钠和NaOH的混合溶液,电解时,阳极发生反应为4OH--4e-
O2↑+2H2O,故答案为:4OH--4e-
O2↑+2H2O;
(3)①上述反应中,涉及Fe元素的化合反应为Fe(OH)2被氧化生成Fe(OH)3,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②含有Fe元素的置换反应为H和W发生的铝热反应,方程式为Fe2O3+2Al
2Fe+A12O3 ,故答案为:Fe2O3+2Al
2Fe+A12O3 ;
(4)Fe与过量硝酸反应的方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O,故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(5)由以上推断可知物质X可能的化学式为(NH4)2Fe(SO4)2,故答案为:(NH4)2Fe(SO4)2.
由此可知X为(NH4)2Fe(SO4)2,A为Fe(OH)2,B为NH3,C为Fe(OH)3,D为O2,E为H2,F为NO,G为HNO3,H为Fe2O3,J为A12O3,K为Fe,W为Al,
(1)B为NH3,实验室常用蘸有浓盐酸的玻璃棒检验,可观察到浓烟生成,故答案为:蘸有浓盐酸的玻璃棒检验;
(2)混合液为硫酸钠和NaOH的混合溶液,电解时,阳极发生反应为4OH--4e-
| ||
| ||
(3)①上述反应中,涉及Fe元素的化合反应为Fe(OH)2被氧化生成Fe(OH)3,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②含有Fe元素的置换反应为H和W发生的铝热反应,方程式为Fe2O3+2Al
| ||
| ||
(4)Fe与过量硝酸反应的方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O,故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(5)由以上推断可知物质X可能的化学式为(NH4)2Fe(SO4)2,故答案为:(NH4)2Fe(SO4)2.
点评:本题综合考查无机物的推断,题目难度较大,解答本题注意以W、K为突破口,注意相关物质的性质及应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
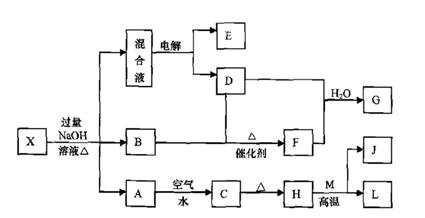
有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略)。其中,B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。
请回答下列问题:
 |
(1)B的电子式为 。
(2)画出元素M的原子结构示意图 。
(3)物质X的化学式为 。
(4)电解混合液时阳极反应式为 。
(5)按要求写出上述转化关系中有关反应的化学方程式:
① 含有L元素的化合反应 。
② 含有L元素的置换反应 。
(6)已知![]()
![]() E气体在D中完全燃烧生成稳定的化合物时,放出
E气体在D中完全燃烧生成稳定的化合物时,放出![]() kJ的热量,写出E燃烧热的热化学方程式 。
kJ的热量,写出E燃烧热的热化学方程式 。
 E气体在D中完全燃烧生成稳定的化合物时,放出
E气体在D中完全燃烧生成稳定的化合物时,放出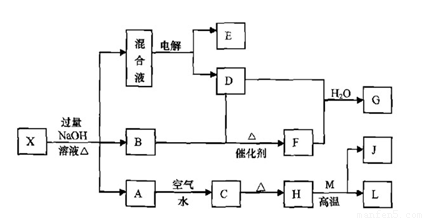
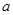
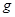 E气体在D中完全燃烧生成稳定的化合物时,放出
E气体在D中完全燃烧生成稳定的化合物时,放出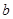 kJ的热量,写出E燃烧热的热化学方程式
。
kJ的热量,写出E燃烧热的热化学方程式
。
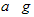 E气体在D中完全燃烧生成稳定的化合物时,放出b kJ的热量,写出该反应的热化学方程式________________________ 。
E气体在D中完全燃烧生成稳定的化合物时,放出b kJ的热量,写出该反应的热化学方程式________________________ 。