题目内容
【题目】为了验证ⅦA族部分元素非金属性递变规律,设计如图进行实验,
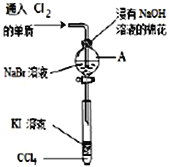
(1)仪器A的名称是______________,A中发生反应的离子方程式是______________________;
(2)为了验证溴和碘的非金属性强弱,通入C12单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡,静置,可观察到的现象的___________________________;
(3)ⅦA族元素,非金属性随着原子序数的增加而逐渐减弱的原因:同主族元素从上到下,________________________,得电能力减弱。
(4)阅读上述实验操作步骤,为确保实验结论可靠,你认为做好本实验最关键的因素是_____________。
【答案】 分液漏斗 2Br-+Cl2=Br2+2Cl- 分层上层几乎无色下层呈紫红色 核电荷数增加,原子半径增大 通入氯气少量
【解析】考查实验方案设计与评价,(1)根据仪器的特点,仪器A为分液漏斗;因为氯气的氧化性强于Br2,因此发生的离子方程式为Cl2+2Br-=2Cl-+Br2;(2)Br2和I2易溶于有机溶剂,四氯化碳不溶于水,出现分层,因为四氯化碳的密度小于水,因此下层为四氯化碳,上层为水溶液,Br2在四氯化碳中颜色是橙红色,即如果下层为橙红色,说明Br的非金属性弱于I,I2在四氯化碳中的颜色是紫红色,即如果下层为紫红色,说明Br的非金属性强于I;(3)同主族随着核电荷数的增加,原子半径增大,对最外层电子的吸引能力减弱,得电子能力减弱;(4)防止氯气过量,氯气把I-氧化,因此最关键的因素是通入氯气的量少。

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目