题目内容
请回答下列问题:
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)除去Na2CO3中混有的NaHCO3的方法是______,其反应原理用化学方程式可表示为______.
(3)某待测液中可能含有Ag+、Fe3+、Na+、SO42-等离子,进行如下实验:
第一步:加入过量的稀盐酸,无白色沉淀生成.
第二步:过滤,在滤液中加入过量的BaCl2溶液,有白色沉淀生成.
第三步:过滤,取少量滤液,滴入2滴KSCN溶液,溶液呈血红色.
①写出第三步中涉及的离子方程式:______.
②上述待测液中一定含有______离子,一定不含有______离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)______.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |
(2)除去Na2CO3中混有的NaHCO3的方法是______,其反应原理用化学方程式可表示为______.
(3)某待测液中可能含有Ag+、Fe3+、Na+、SO42-等离子,进行如下实验:
第一步:加入过量的稀盐酸,无白色沉淀生成.
第二步:过滤,在滤液中加入过量的BaCl2溶液,有白色沉淀生成.
第三步:过滤,取少量滤液,滴入2滴KSCN溶液,溶液呈血红色.
①写出第三步中涉及的离子方程式:______.
②上述待测液中一定含有______离子,一定不含有______离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)______.
(1)工业制氧气的原理是分离液态空气,由液态变成气态时由于氧气与氮气沸点不同,然后升温沸点低的先汽化溢出,故答案为:N2;
(2)Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是固体加热分解,发生的反应为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:加热;2NaHCO3
Na2CO3+H2O+CO2↑;
(3)①三价铁离子和硫氰酸根离子形成血红色溶液,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
②加入过量的稀盐酸,无白色沉淀生成,说明无Ag+,在滤液中加入过量的BaCl2溶液,有白色沉淀生成,说明含有SO42-,滴入2滴KSCN溶液,溶液呈血红色说明含Fe3+,钠的焰色反应呈黄色,故答案为:SO42-、Fe3+;Ag+;焰色反应呈黄色.
(2)Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是固体加热分解,发生的反应为:2NaHCO3
| ||
| ||
(3)①三价铁离子和硫氰酸根离子形成血红色溶液,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
②加入过量的稀盐酸,无白色沉淀生成,说明无Ag+,在滤液中加入过量的BaCl2溶液,有白色沉淀生成,说明含有SO42-,滴入2滴KSCN溶液,溶液呈血红色说明含Fe3+,钠的焰色反应呈黄色,故答案为:SO42-、Fe3+;Ag+;焰色反应呈黄色.

练习册系列答案
相关题目
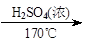 CH2=CH2+H2O
CH2=CH2+H2O