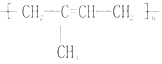题目内容
【题目】如图是元素周期表的一部分。
|
|
|
|
|
|
|
| 0 |
第二 周期 | 3 锂 6.941 | 4 铍 9.012 | 5 硼 10.81 |
| 7 氮 14.01 | 8 氧 16.00 | 9 氟 19.00 | 10 氖 20.18 |
第三 周期 | 11 钠 22.99 |
24.31 | 13 铝 26.98 | 14 硅 28.09 |
30.97 | 16 硫 32.06 | 17 氯 35.45 | 18 氩 39.95 |
请结合上图的元素周期表回答下列问题:
(1)金属性最强的是_______,原子半径最小的是_______;(填元素符号)
(2)相对原子质量为30.97的元素属_______(填“金属”或“非金属”),位置![]() 中的元素原子核内的质子数为_______(填数值);
中的元素原子核内的质子数为_______(填数值);
(3)请画出位置![]() 中元素的离子结构示意图____________。
中元素的离子结构示意图____________。
(4)位置![]() 中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,
中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,![]() 该分子中所含化学键个数为___________。
该分子中所含化学键个数为___________。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,请写出它溶于烧碱溶液的离子反应方程式________________。
(6)由Na、H、S、O四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(7)科学家认为存在NH5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________________________,写出NH5的电子式______________。
【答案】 ![]() F 非金属 6
F 非金属 6 ![]() 非极性共价键
非极性共价键 ![]()
![]() HSO3-+ H2O + Cl2=SO42-+ 2Cl-+3H+ NH5+H2O=H2↑+NH3·H2O或NH5+H2O=H2↑+NH3+H2O
HSO3-+ H2O + Cl2=SO42-+ 2Cl-+3H+ NH5+H2O=H2↑+NH3·H2O或NH5+H2O=H2↑+NH3+H2O 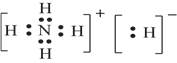
【解析】根据元素周期表,①、②、③依次代表C、Mg、P元素。
(1)根据同周期从左到右原子半径逐渐减小,元素的金属性逐渐减弱,元素的非金属性逐渐增强;同主族从上到下原子半径逐渐增大,元素的金属性逐渐增强,元素的非金属性逐渐减弱。
(2)P元素属于非金属元素。C的质子数为6。
(3)Mg2+的核电荷数为12,K、L层依次排2、8个电子。
(4)P的单质中空间结构为正四面体的是P4,1个P4中含6个P-P键。
(5)第三周期非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,该元素为Si,最高价氧化物对应的水化物为H2SiO3。
(6)由Na、H、S、O四种元素组成的一种离子化合物A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,A属于弱酸的酸式盐且具有还原性,A为NaHSO3。
(7)NH5与水剧烈反应放出气体,所得水溶液呈弱碱性,说明NH5与H2O反应生成NH3·H2O和H2。NH5类似金属的氢化物。
(1)根据同周期从左到右原子半径逐渐减小,元素的金属性逐渐减弱,元素的非金属性逐渐增强;同主族从上到下原子半径逐渐增大,元素的金属性逐渐增强,元素的非金属性逐渐减弱;金属性最强的是左下角的Na,原子半径最小的是右上角的F。
(2)相对原子质量为30.97的元素是P元素,P元素属于非金属元素。位置①中的元素为C元素,C原子核内质子数为6。
(3)位置②的元素为Mg元素,Mg2+的离子结构示意图为![]() 。
。
(4)位置③的元素为P元素,P的一种单质分子的空间结构为正四面体,该单质的分子式为P4,该分子中P原子间形成非极性共价键。该分子中的键角为60,1个P4分子中含6个P-P键,1mol该分子中含6molP-P键,所含共价键个数为6NA。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,该元素为Si,其最高价氧化物对应的水化物为H2SiO3,H2SiO3与烧碱反应的化学方程式为H2SiO3+2NaOH=Na2SiO3+2H2O,离子方程式为H2SiO3+2OH-=SiO32-+2H2O。
(6)由Na、H、S、O四种元素组成的一种离子化合物A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,A属于弱酸的酸式盐且具有还原性,A为NaHSO3;A与氯水反应的化学方程式为Cl2+NaHSO3+H2O=NaHSO4+2HCl,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42-+3H+。
(7)NH5与水剧烈反应放出气体,所得水溶液呈弱碱性,说明NH5与H2O反应生成NH3·H2O和H2,该反应的化学方程式为NH5+H2O=NH3·H2O+H2↑。NH5具有与金属氢化物相似的性质,NH5的化学式为NH4H,NH5的电子式为![]() 。
。

【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )

M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D