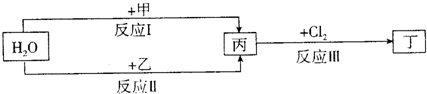
题目内容
有A、B两种常见化合物组成的混合物,其焰色反应均呈现黄色,相互转化关系如图(其他物质均已略去).
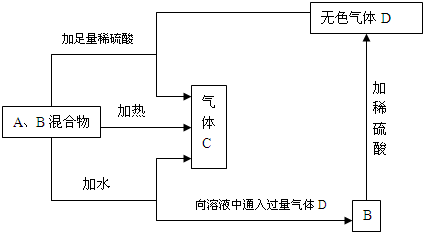
回答下列问题:
(1)化学式:A ,B ,C .
(2)B加热产生D的化学方程式 .
(3)B加稀硫酸产生D的离子方程式 .

回答下列问题:
(1)化学式:A
(2)B加热产生D的化学方程式
(3)B加稀硫酸产生D的离子方程式
分析:A、B焰色反应呈黄色,则A、B为钠的化合物.由A与B的混合物与水或硫酸反应产生气体C,可知混合物中必含有Na2O2,且C为O2.又因为加热A与B的混合物产生O2,说明另一物质的分解产物必有H2O和CO2,即另一种物质为NaHCO3.A与B的混合物溶于水的产物与D反应生成B,则B为NaHCO3,D为CO2,A为Na2O2,据此解答.
解答:解:A、B焰色反应呈黄色,则A、B为钠的化合物.由A与B的混合物与水或硫酸反应产生气体C,可知混合物中必含有Na2O2,且C为O2.又因为加热A与B的混合物产生O2,说明另一物质的分解产物必有H2O和CO2,即另一种物质为NaHCO3.A与B的混合物溶于水的产物与D反应生成B,则B为NaHCO3,D为CO2,A为Na2O2,
(1)由上述分析可知,A为Na2O2,B为NaHCO3,C为O2,
故答案为:Na2O2;NaHCO3;O2;
(2)NaHCO3加热分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3
Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(3)NaHCO3与稀硫酸反应生成硫酸钠、二氧化碳与水,反应离子方程式为:HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑.
(1)由上述分析可知,A为Na2O2,B为NaHCO3,C为O2,
故答案为:Na2O2;NaHCO3;O2;
(2)NaHCO3加热分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3
| ||
故答案为:2NaHCO3
| ||
(3)NaHCO3与稀硫酸反应生成硫酸钠、二氧化碳与水,反应离子方程式为:HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑.
点评:本题考查无机物的推断,涉及Na盐酸化合物性质与相互转化,难度中等,关键是根据焰色反应推断含有Na元素,再结合混合物与水、酸反应都去气体生成确定一定含有过氧化钠.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19。在它们的化合物中,主要化合价均不止一种,但都有一种相同的化合价,C的单质常用于太阳能电池。它们的一些物理量如下:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 单质的沸点/℃ | 444.6 | 4827 | 2355 | –195.8 |
(1)A的元素符号为__________,D元素在周期表第_______周期、第_______族。
(2)在常温下,B与C的最高价氧化物分别为气态和固态,原因是____________________。
(3)含D的两种常见化合物发生化合反应可生成一种离子化合物,该离子化合物撞击时可分解为两种非金属单质和一种化合物,其中一种为D单质,写出该分解反应的化学方程式____________________________________________________________________。
(4)A、B、C、D均能分别形成含18个电子的氢化物,这些氢化物的分子式分别是________________________________________________。
(5)B、D及氢元素中的两种或三种可形成多种含14个电子的化合物,其中空间构型为直线型的是_______________________和_______________________(写结构式)。
 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.