题目内容
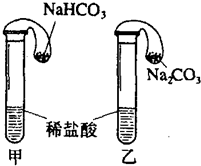 化学活动课上,某学生分别用右图所示的甲、乙两装置来探究“等质量的NaHCO3和Na2CO3与足量稀盐酸的反应“.在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查).请回答:
化学活动课上,某学生分别用右图所示的甲、乙两装置来探究“等质量的NaHCO3和Na2CO3与足量稀盐酸的反应“.在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查).请回答:(1)反应开始时,
(2)若所用Na2CO3固体中混有少量NaHCO3,则除去NaHCO3的方法是
分析:(1)等质量的NaHCO3和Na2CO3与足量稀盐酸的反应,由n=
可知,NaHCO3的物质的量大,由C原子守恒可知,NaHCO3生成气体多,且反应速率快;
(2)NaHCO3受热易分解,而Na2CO3不能,以此除杂.
| m |
| M |
(2)NaHCO3受热易分解,而Na2CO3不能,以此除杂.
解答:解:(1)等质量的NaHCO3和Na2CO3与足量稀盐酸的反应,由n=
可知,NaHCO3的物质的量大,由C原子守恒可知,NaHCO3生成气体多且反应速率快,则甲中变化快且气球大,而乙中气球体积后变大,乙中发生CO32-+2H+═CO2↑+H2O,
故答案为:乙;CO32-+2H+═CO2↑+H2O;
(2)NaHCO3受热易分解生成碳酸钠,而Na2CO3不能,则Na2CO3固体中混有少量NaHCO3,除去NaHCO3的方法是加热至质量不再变,故答案为:加热至质量不再变.
| m |
| M |
故答案为:乙;CO32-+2H+═CO2↑+H2O;
(2)NaHCO3受热易分解生成碳酸钠,而Na2CO3不能,则Na2CO3固体中混有少量NaHCO3,除去NaHCO3的方法是加热至质量不再变,故答案为:加热至质量不再变.
点评:本题考查碳酸钠、碳酸氢钠的性质实验,把握实验中气球变化与反应的关系为解答的关键,注意等量的两种盐与足量酸反应时碳酸氢钠反应快且生成气体多,题目难度不大.

练习册系列答案
相关题目
 某学校设计了一节实验活动课,让学生从废
某学校设计了一节实验活动课,让学生从废
旧干电池回收碳棒、锌皮、![]() 、
、![]() 、
、![]() 等物质,
等物质,
整个实验过程如下,请回答有关问题。
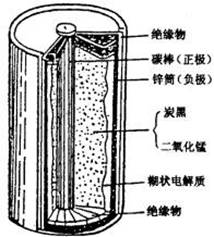
(1)有关干电池的基本构造和工作原理。右图是干电池的
基本构造图。干电池工作时负极上的电极反应式子是 ,![]()
的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是 。
锌皮和碳棒的回收。用钳子和剪子开回收的干电池的锌筒,将锌皮和碳棒取出,并用手刷刷洗干净,将电池内的黑色粉末移入小烧杯中。
氧化铵、氯化锌的提取、检验和分离。
如何从黑色粉末中提取![]() 和
和![]() 等晶体的混合物?写出简要的实验步骤。
等晶体的混合物?写出简要的实验步骤。
设计简单的实验证明所得晶体中含有![]() 和
和![]() [一直
[一直![]() 是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
| 实验步骤 | 实验现象 | 实验结论 | 有关离子方程式 |
| (a) | |||
| (b) | (c) | 说明有 | (d) |
| (e) | (f) | 说明有 |
(a) ,(b) ,(c) ,(d) ,(e) ,(f) ,
(4)最后剩余的黑色残渣的主要成分是![]() ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可) 。
,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可) 。