题目内容
二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1="a" kJ·mol-1
NH2CO2NH4(s) △H1="a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1=__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅱ的△S______(填>或<)0,一般在__________情况下有利于该反应的进行。
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是________(填提高或降低)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________。


(4)反应Ⅰ的平衡常数表达式K1=____________________;如果起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,平衡常数K1将__________(填增大、减少、不变)。
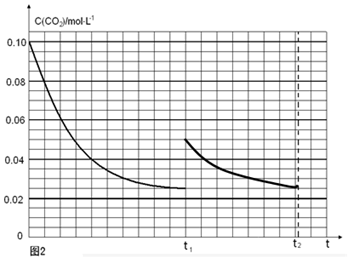
(5)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(6)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。
反应Ⅰ:2NH3(g)+CO2(g)
 NH2CO2NH4(s) △H1="a" kJ·mol-1
NH2CO2NH4(s) △H1="a" kJ·mol-1反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1请回答下列问题:
(1)反应Ⅰ的△H1=__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅱ的△S______(填>或<)0,一般在__________情况下有利于该反应的进行。
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是________(填提高或降低)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________。


(4)反应Ⅰ的平衡常数表达式K1=____________________;如果起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,平衡常数K1将__________(填增大、减少、不变)。
(5)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(6)尿素在土壤中会发生反应CO(NH2)2+2H2O
 (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。| A.NH2COONH4 | B.H2NOCCH2CH2CONH2 |
| C.HOCH2CH2OH | D.HOCH2CH2NH2 |
(14分)(1)-159.47(2分) (2)>(1分) 高温(1分)
(3)①降低(1分)②温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低,(2分,给出合理解释即可给分)。
(4)K1=1/[c2(NH3)·c(CO2)] (2分),减少(1分)
(5)
 (注意:曲线的起点、平衡点和变化趋势共2分)
(注意:曲线的起点、平衡点和变化趋势共2分)
(6)A、B(2分)
(3)①降低(1分)②温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低,(2分,给出合理解释即可给分)。
(4)K1=1/[c2(NH3)·c(CO2)] (2分),减少(1分)
(5)
 (注意:曲线的起点、平衡点和变化趋势共2分)
(注意:曲线的起点、平衡点和变化趋势共2分)(6)A、B(2分)
试题分析:解:(1)反应Ⅰ:2NH3(g)+CO2(g)
 NH2CO2NH4(s)△H1="a" kJ·mol-1
NH2CO2NH4(s)△H1="a" kJ·mol-1反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g)
 NH2CO2NH4(s)△H1=a=-159.47kJ·mol-1,
NH2CO2NH4(s)△H1=a=-159.47kJ·mol-1,故答案为:-159.47;
(2)反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:>;高温;
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:>;高温;(3)①反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;②反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,是放热反应,升温高于190℃,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,是放热反应,升温高于190℃,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(4)反应Ⅰ:2NH3(g)+CO2(g)
 NH2CO2NH4(s)△H1=-159.47kJ?mol-1,平衡常数K=
NH2CO2NH4(s)△H1=-159.47kJ?mol-1,平衡常数K=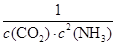 ;
;起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,反应是放热反应,随反应进行温度升高平衡逆向进行,平衡常数减小;
(5)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g)
 NH2CO2NH4(s)
NH2CO2NH4(s)起始量(mol·L-1) 0.2 0.1 0
变化量(mol·L-1) 0.15 0.075
平衡量(mol·L-1) 0.05 0.025
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示.若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol·L-1,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为:
 ;
;(6)尿素在土壤中会发生反应CO(NH2)2+2H2O
 (NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:
(NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:A.NH2COONH4,结构中含有与羰基连接的氨基,故A符合;
B.H2NOCCH2CH2CONH2结构中含有与羰基连接的氨基,故B符合;
C.HOCH2CH2OH,结构中不含有氨基,故C不符合;
D.HOCH2CH2NH2,分子中的氨基不是和羰基连接,不具备次性质,故D不符合;
故答案为:A、B。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
 CO(g)+H2(g)。
CO(g)+H2(g)。 O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1 CO2(g)+H2O(g)
CO2(g)+H2O(g)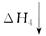

 CO(g)+H2O(g)+
CO(g)+H2O(g)+

 在光照和点燃条件的△H不同。
在光照和点燃条件的△H不同。 在室温下可自发进行:则该反应的△H>0
在室温下可自发进行:则该反应的△H>0