题目内容
A、B、C、D、E代表5种元素.请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为
(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为
N
N
.(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为
Cl
Cl
,C的元素符号为K
K
.(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为
Fe
Fe
,其基态原子的电子排布式为[Ar]3d64s2
[Ar]3d64s2
.D元素在元素周期表中的位置是第四周期Ⅷ族
第四周期Ⅷ族
.(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为
Cu
Cu
,其基态原子的电子排布式为[Ar]3d104s1
[Ar]3d104s1
.E元素在元素周期表中的分区中属于ds
ds
区元素,其单质在一定条件下能与浓硫酸反应,试写出该反应方程式Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
.
| ||
分析:(1)A元素基态原子的最外层有3个未成对电子,核外电子排布应为ns2np3;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子;
(3)D元素的正三价离子的3d轨道为半充满,电子数为5,应为Fe元素;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,应为Cu,原子序数为29.
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子;
(3)D元素的正三价离子的3d轨道为半充满,电子数为5,应为Fe元素;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,应为Cu,原子序数为29.
解答:解:(1)A元素基态原子的核外电子排布应为ns2np3,应为N元素,故答案为:N;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子,阴离子为Cl-,含有Cl元素,阳离子为K+,含有K元素,故答案为:Cl;K;
(3)D元素的正三价离子的3d轨道为半充满,电子数为5,则基态原子的电子排布式为[Ar]3d64s2,应为Fe,位于周期表第四周期Ⅷ族,故答案为:Fe;[Ar]3d64s2;第四周期Ⅷ族;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子的电子排布式为[Ar]3d104s1,应为Cu,在元素周期表中的分区中属于ds区,可浓硫酸在加热条件下发生反应,反应的方程式为Cu+2H2SO4(浓)
CuSO4+SO2+2H2O,
故答案为:Cu;[Ar]3d104s1;ds;Cu+2H2SO4(浓)
CuSO4+SO2+2H2O.
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子,阴离子为Cl-,含有Cl元素,阳离子为K+,含有K元素,故答案为:Cl;K;
(3)D元素的正三价离子的3d轨道为半充满,电子数为5,则基态原子的电子排布式为[Ar]3d64s2,应为Fe,位于周期表第四周期Ⅷ族,故答案为:Fe;[Ar]3d64s2;第四周期Ⅷ族;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子的电子排布式为[Ar]3d104s1,应为Cu,在元素周期表中的分区中属于ds区,可浓硫酸在加热条件下发生反应,反应的方程式为Cu+2H2SO4(浓)
| ||
故答案为:Cu;[Ar]3d104s1;ds;Cu+2H2SO4(浓)
| ||
点评:本题考查原子核外电子排布,题目难度不大,注意把握原子核外电子的排布规律,题中从该角度作为判断元素种类的依据,学习中注意积累.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
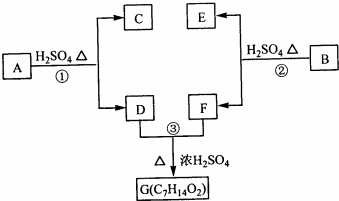
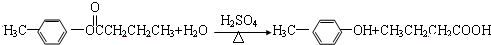

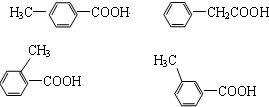
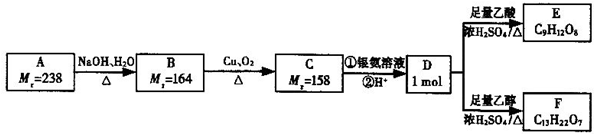
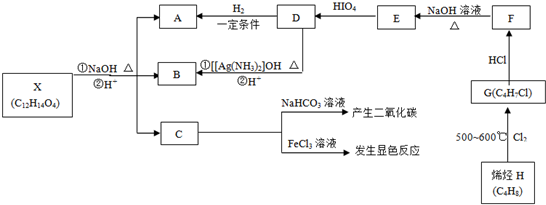
 ,现有A、B、C、D、E、F、G、H八种有机物,存在如下图所示的转化关系:
,现有A、B、C、D、E、F、G、H八种有机物,存在如下图所示的转化关系:


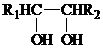 +HIO4→R1CHO+R2CHO+HIO3+H2O
+HIO4→R1CHO+R2CHO+HIO3+H2O
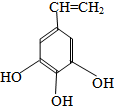 、
、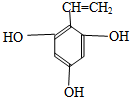

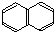 存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和
存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和