题目内容
【题目】Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH = kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH = kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为 。
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2(g)+CH4(g)![]() CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:

①250~300℃时,乙酸的生成速率降低的原因是 。
②300~400℃时,乙酸的生成速率升高的原因是 。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
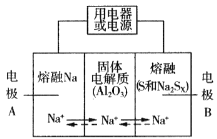
(4)根据上表数据,判断该电池工作的适宜温度应为 (填字母序号)。
A.100℃以下
B.100℃~300℃
C.300℃~350℃
D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是 (填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为![]() 2e
2e![]() xS
xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的pH变为13时,电路中通过的电子的物质的量为 mol,两极的反应物的质量差为 g。(假设电解前两极的反应物的质量相等)
【答案】Ⅰ.(1)a +2b –2c
(2)3CO + 3H2 ![]() CH3OCH3 + CO2
CH3OCH3 + CO2
(3)①催化剂的催化效率降低,化学反应速率降低 ②温度升高,化学反应速率加快
Ⅱ.(4)C
(5)AD
(6)0.05 2.3
【解析】本题考查了盖斯定律的应用、氧化还原反应方程式书写、影响反应速率的因素、原电池和电解池。
Ⅰ.(1)已知①CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H1=a kJ/mol
CO2(g)+2H2O(g) △H1=a kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=b kJ/mol
CO2(g)+H2(g) △H2=b kJ/mol
③2CO(g)+O2(g)![]() 2CO2(g) △H3=c kJ/mol
2CO2(g) △H3=c kJ/mol
据盖斯定律,①+2×②2×③得:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=(a+2b2c)kJ/mol;
2CO(g)+2H2(g) △H=(a+2b2c)kJ/mol;
(2)根据反应物和生成物可知,参与大气循环的无机化合物为二氧化碳,据原子守恒书写化学方程式为:3CO+3H2![]() CH3OCH3+CO2;
CH3OCH3+CO2;
(3)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
②温度升高,化学反应速率加快,故答案为:温度升高,化学反应速率加快;
Ⅱ.(4)原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有C符合;
(5)A.通过以上分析知,充电时A是阴极,应该连接电源负极,正确;B.放电时,B是正极、A是负极,Na+由A向B移动,错误;C.充电时,电极A发生还原反应,应连接电源的负极,错误;D.充电时,B是阳极,电极反应式为![]() 2e
2e![]() xS,正确;故答案为:AD;
xS,正确;故答案为:AD;
(6)电解NaCl溶液的反应式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,每生成2 mol NaOH转移电子2 mol,当溶液的pH变为13时,c(OH)=0.1 mol/L,生成NaOH物质的量为0.05 mol,转移电子0.05 mol;转移0.05 mol电子,负极Na质量减少1.15 g,正极质量变化1.15 g,两极的反应物的质量差为2.3 g。
2NaOH+H2↑+Cl2↑,每生成2 mol NaOH转移电子2 mol,当溶液的pH变为13时,c(OH)=0.1 mol/L,生成NaOH物质的量为0.05 mol,转移电子0.05 mol;转移0.05 mol电子,负极Na质量减少1.15 g,正极质量变化1.15 g,两极的反应物的质量差为2.3 g。

 名校课堂系列答案
名校课堂系列答案