题目内容
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:

(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
【答案】适度加热、适量增加硫酸的浓度、将烧渣粉碎、搅拌等FeS2+2Fe3++=3Fe2++2S取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反之,未反应完全Fe(OH)2FeSO4+2NH4HCO3=(NH4)2SO4+FeCO3↓+H2O+CO2↑取少许最后一次洗涤液于试管中,滴加稍过量稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净O2、H2O21.6
【解析】
烧渣(主要成分Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中含有硫酸铵、碳酸铵。
可以通过加热、增加硫酸的浓度、将烧渣粉碎、搅拌等措施提高酸浸时反应速率;(2)①Fe3+被FeS2还原成Fe2+,发生反应的离子方程式包括:FeS2+14Fe3++8H2O=15Fe2++2SO42—+16H+、FeS2+2Fe3++=3Fe2++2S;②Fe3+与KSCN溶液反应呈血红色,检验Fe3+是否反应完全可选择KSCN溶液,具体方法是取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反之,未反应完全;(3)①pH过高时溶液生成氢氧化亚铁沉淀;②加入NH4HCO3生成“沉淀”的化学方程式为FeSO4+2NH4HCO3=(NH4)2SO4+FeCO3↓+H2O+CO2↑;③碳酸亚铁表面会附着硫酸铵,所以检验FeCO3是否洗净,可以检验洗涤滤液中是否有硫酸根离子,具体方法为:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净;(4)红褐色固体是Fe(OH)3,FeCO3、H2O和O2反应生成Fe(OH)3和CO2;(5)在空气中煅烧FeCO3生成氧化铁和氧化亚铁,设Fe2O3的物质的量为x mol,FeO的物质的量为y mol,根据化学反应前后铁元素守恒可得:①2x+y=0.3,②160x+72y=23.76,联立解得x=0.135,可知Fe2O3的质量为21.6g。

【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是______________。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:_________
![]()
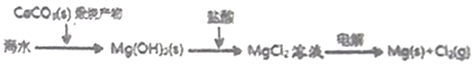
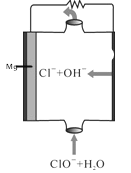
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是________________________________。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是______________________。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO_______g。