题目内容
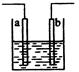
如图所示:甲为稀硫酸,乙为氯化铜溶液,电极材料用元素符号表示,则下列说法中正确的是


| A.甲装置将电能转变为化学能 |
| B.乙装置中左边的碳棒上有红色金属析出 |
| C.甲中Cu为阳极 |
| D.甲中Fe的质量少了0.56g,乙中右边的碳棒质量增加了0.64g |
D
试题分析:铁和稀硫酸反应生成氢气,则根据装置图可知,甲是原电池,乙是电解池,A不正确。甲中铁是负极,铜是正极。所以乙装置中左边的碳棒是阳极,溶液中的氯离子放电,生成氯气,B不正确;C不正确,D正确,0.56g铁是0.01mol,失去0.02mol,则根据电子的得失守恒可知,乙中右边的碳棒析出铜的物质的量是0.01mol,质量是0.64g,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力。

练习册系列答案
相关题目

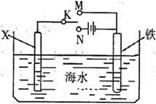
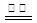 KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是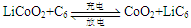 ,下列说法正确的是( )
,下列说法正确的是( )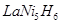 (在反应前后La、Ni的化合价为0),其电池的反应通常表示为:
(在反应前后La、Ni的化合价为0),其电池的反应通常表示为: LaNi5+6Ni(OH)2
LaNi5+6Ni(OH)2