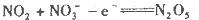题目内容
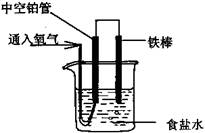
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确是
| A.阳极反应为Fe-2e- =Fe2+ |
| B.电解过程中溶液pH不会变化 |
| C.过程中有Fe(OH)3沉淀生成 |
| D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
B
试题分析:A、铁为活泼电极,铁板作阳极时电解过程中电极本身失电子,电极反应式为: Fe-2e-=Fe2+,正确;B、根据题意知,反应过程中溶液中的氢离子浓度减小,溶液pH增大,错误;C、根据Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O知,反应过程中消耗了大量H+,使得Cr3+和Fe3+都转化为氢氧化物沉淀,正确;D、电路中每转移12 mol电子,有6mol Fe2+,结合题给反应知最多有1 mol Cr2O72-被还原,正确。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目