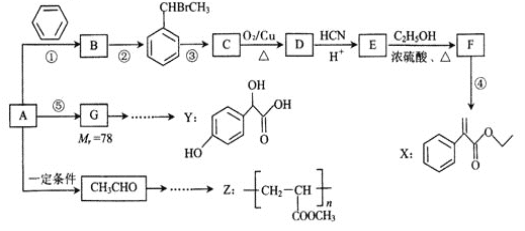
题目内容
【题目】
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
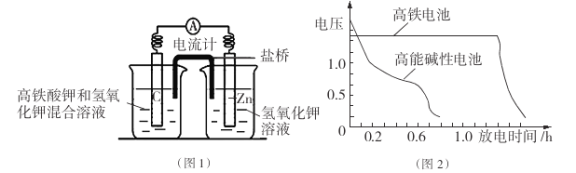
(1)该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作十分钟,理论消耗Zn g(已知F="96500" C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
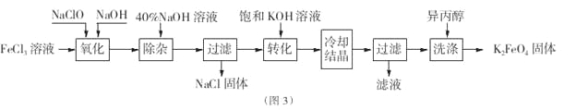
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
(4)完成“氧化”过程中反应的化学方程式:
![]()
其中氧化剂是 (填化学式)。
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×![]() ,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
【答案】(1)FeO42﹣+4H2O+3e﹣=Fe(OH)3↓+5OH﹣;0.2
(2)右;左(3)使用时间长、工作电压稳定
(4)2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O;NaClO
(5)减小高铁酸钾的溶解,促进高铁酸钾晶体析出(6)2.5
【解析】试题分析:(1)放电时高铁酸钾为正极,正极发生还原反应,电极反应式为FeO42﹣+4H2O+3e﹣=Fe(OH)3↓+5OH﹣;若维持电流强度为1A,电池工作十分钟,转移电子的物质的量为1×10×60÷96500=0.0062176mol。理论消耗Zn的质量 0.0062176mol÷2×65=0.2g(已知F="96500" C/mol)。
(2)电池工作时,阴离子移向负极,阳离子移向正极,所以盐桥中氯离子向右移动;若用阳离子交换膜代替盐桥,则钾离子向左移动。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有使用时间长、工作电压稳定
Ⅱ.(4)2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O氧化剂所含元素化合价降低,氧化剂是NaClO;
(5)加入饱和KOH溶液的目的是减小高铁酸钾的溶解,促进高铁酸钾晶体析出;
(6)已知25℃时Ksp[Fe(OH)3]=4.0×![]() ,此温度下若在实验室中配制5mol/L l00mL FeCl3
,此温度下若在实验室中配制5mol/L l00mL FeCl3
溶液,为使配制过程中不出现浑浊现象![]() ,
,![]() ,
,![]() 则至少需要加入2.5mL 2 mol/L的盐酸。
则至少需要加入2.5mL 2 mol/L的盐酸。

【题目】已知25℃时一些难溶物质的溶度积常数如下:
化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
根据上表数据,判断下列化学方程式不正确的是
A. 2AgCl+Na2S═2NaCl+Ag2S
B. MgCO3+H2O![]() Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
C. ZnS+2H2O═Zn(OH)2+H2S↑
D. Mg(HCO3)2+2Ca(OH)2═Mg(OH)2↓+2CaCO3↓+2H2O