题目内容
(物质结构与性质)化合物YX2、ZX2中X、Y、Z都是前三周期元素,X与Y同周期,Y与Z同主族,Y元素的最外层中P轨道上的电子数等于前一电子层电子总数,X原子最外层的P轨道中有一个轨道填充了2个电子。则
(1)X原子的电子排布式是 ,Y原子的价层电子轨道表示式是
(2)YX2的分子构型是 ,YX2的熔沸点比ZX2 ,(选填“高”或“低”),理由是
(3)YX2分子中,Y原子的杂化类型是 ,一个YX2分子中含 个![]() 键。
键。
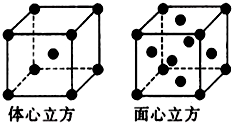
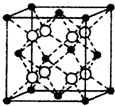
(4)下图表示一些晶体的结构(晶胞),其中代表YX2的是

(1) ![]() ,
,![]() (2) 直线型,低⑶SP杂化,2个∏键⑷B
(2) 直线型,低⑶SP杂化,2个∏键⑷B
解析:
根据题意:Y元素的最外层中P轨道上的电子数是前一电子层电子总数,因为P轨道最多能排6个电子﹤8,则Y元素只有两个电子层,且最外层P轨道上只有2个电子,其最外层共有4个电子,Y元素为碳元素,Z与Y同主族,Z为硅元素,X与Y同周期,则X有2个电子层,X原子最外层P轨道上有一个轨道填充了2个电子,依据电子排布规律可知P轨道共有4个电子。则X为氧元素。问题⑴:根据核外电子排布规律可以写出X原子的核外电子排布式为![]() ,Y原子的价层电子轨道表示式为:
,Y原子的价层电子轨道表示式为:![]()
问题⑵:YX2分子是CO2 ,分子构型是直线型分子,ZX2是SiO2,因为CO2 是分子晶体,SiO2是原子晶体,所以CO2 的熔点比SiO2的熔点低。
问题⑶YX2是CO2 ,由CO2分子是直线型分子可以推断出CO2 分子中C原子的杂化类型是SP杂化。CO2 分子内的共价键是碳氧双键(C=O),每一个双键中有1个∏键,共有2个∏键。
问题⑷CO2 属于分子晶体,结合选项可以选出其晶体结构是B。

 (2013?烟台一模)【化学--物质结构与性质】
(2013?烟台一模)【化学--物质结构与性质】