题目内容
(16分)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是 。
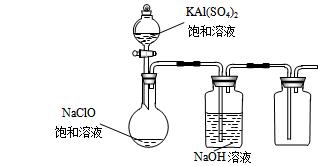
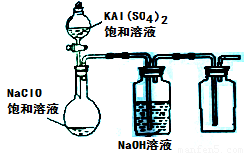
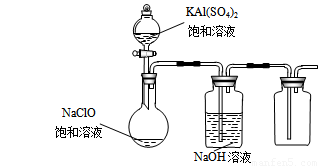
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
① 打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀 。反应的离子方程式是 。
② 将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带余烬的木条复燃。写出在光照下混合液中反应的化学方程式是
。
(4)若将V1 mL 0.1mol/L KAl(SO4)2溶液和V2mL 0.1mol/LBa(OH)2溶液混合。当产生沉淀物质的量最多时,V1:V2 = 。
(共16分)
(1)ClO- + H2OHClO+ OH-
(2)漂白纸浆
(3)① Al3+ + 3ClO- + 3H2O=3HClO + Al(OH)3↓
② 4 HClO 2Cl2↑+O2↑+ 2H2O
(4) 2 :3
解析:

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
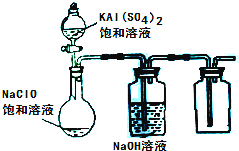 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.