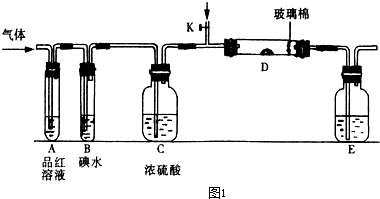
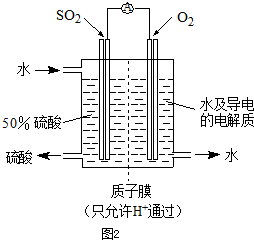
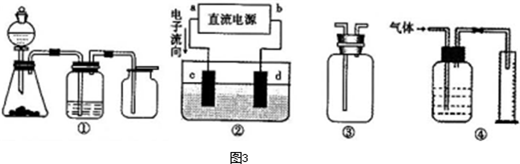
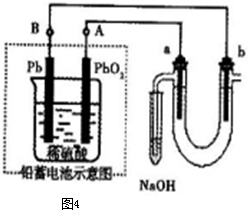
题目内容
| A.1mol任何气体的体积都约为22.4L |
| B.非标准状况下,1mol 任何气体的体积都不可能为22.4L |
| C.标准状况下,1molH2和1molH2O所占的体积都约为22.4L |
| D.在温度和压强相同的状况下,相同质量的一氧化碳和氮气体积相同 |
B、由pV=nRT可知,气体摩尔体积为22.4L/mol所处的状态不一定是标准状况,所以非标准状况下,1mol 任何气体的体积都可能为22.4L,故B错误;
C、标准状况下,H2O的状态为液态,所以标准状况下,1molH2O所占的体积都不等于22.4L,故C错误;
D、相同质量的一氧化碳和氮气的物质的量相等,一定温度和压强下,气态物质的体积大小主要由气体的物质的量决定,所以在温度和压强相同的状况下,相同质量的一氧化碳和氮气体积相同,故D正确.
故选:D.

 发散思维新课堂系列答案
发散思维新课堂系列答案相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2 SO2(g)+O2 (g)2SO3(g) △H=-196.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| SO2 | O2 | SO3 | ||
| ① | 2 | 1 | 0 | 放出热量a kJ |
| ② | 1 | 0.5 | 1 | 放出热量b kJ |
| ③ | 4 | 2 | 0 | 放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a = b B.三个容器内反应的平衡常数:③>②>①
C.平衡时SO3气体的体积分数:③>① D.SO2的转化率:②>①>③
【解析】平衡的建立和途径无关,所以②中相当于是2molSO2和1molO2,即①②中的平衡是等效的。但在反应过程中实际消耗的氧气是不相同的,所以a不等于b。温度相同,平衡常数就相同,B不正确。③相当于增大压强,平衡向正反应方向移动,所以SO2的转化率增大,SO3的体积分数也增大。因此正确的答案是C。
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2 SO2(g)+O2 (g) 2SO3(g)
△H=-196.4 kJ/mol。
2SO3(g)
△H=-196.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
|
容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
|
SO2 |
O2 |
SO3 |
||
|
① |
2 |
1 |
0 |
放出热量a kJ |
|
② |
1 |
0.5 |
1 |
放出热量b kJ |
|
③ |
4 |
2 |
0 |
放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a = b B.三个容器内反应的平衡常数:③>②>①
C.平衡时SO3气体的体积分数:③>① D.SO2的转化率:②>①>③
【解析】平衡的建立和途径无关,所以②中相当于是2molSO2和1molO2,即①②中的平衡是等效的。但在反应过程中实际消耗的氧气是不相同的,所以a不等于b。温度相同,平衡常数就相同,B不正确。③相当于增大压强,平衡向正反应方向移动,所以SO2的转化率增大,SO3的体积分数也增大。因此正确的答案是C。