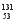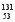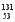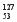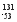题目内容
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为C2++2e-=C,B-2e-=B2+,则A、B、C、D金属性由强到弱的顺序为( )。
B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为C2++2e-=C,B-2e-=B2+,则A、B、C、D金属性由强到弱的顺序为( )。
A.A>B>C>D B.A>B>D>C
C.D>A>B>C D.D>C>A>B
C
【解析】根据:“当A、B组成原电池时,电子流动方向A B”可知金属性A>B;根据“当A、D组成原电池时,A为正极”可知金属性D>A;根据“B与C构成原电池时,电极反应式为C2++2e-=C,B-2e-=B2+”可知金属性B>C,综合可知金属性顺序为D>A>B>C。
B”可知金属性A>B;根据“当A、D组成原电池时,A为正极”可知金属性D>A;根据“B与C构成原电池时,电极反应式为C2++2e-=C,B-2e-=B2+”可知金属性B>C,综合可知金属性顺序为D>A>B>C。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
已知反应H2(g)+Br2(l)=2HBr(g)在25 ℃、101 kPa下进行,放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
| H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为( )。
A.404 B.260 C.230 D.200