题目内容
【题目】已知反应:A(s)+3B(g)![]() 2C(g)ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示:下列说法正确的是( )
2C(g)ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示:下列说法正确的是( )
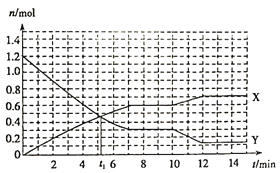
A.前4 min,用A表示反应速率为v(A)=0.005mol/(L·min)
B.X曲线表示B的物质的量随时间变化的关系
C.第t1 min时说明反应达到了平衡
D.第10 min时,可能采取了降温
【答案】D
【解析】
试题分析:A、A是固体,浓度视为常数,故错误;B、B是反应物,物质的量减小,X曲线不表示B的物质的量浓度随时间的变化,故错误;C、t1时刻以后物质的量改变,说明没有达到平衡,故错误;D、第10min时,生成物的物质的量增大,反应物物质的量减小,说明平衡向正反应方向移动,此反应正反应方向是放热反应,可能是降温造成的,故正确。

【题目】A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的内层电子数是最外层电子数的5倍 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与C形成的化合物AC2的电子式是__________。
(2) 下列事实能证明C和E的非金属性强弱的是 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是 (填化学式),它与足量NaOH溶液在加热时反应的离子方程为: 。
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式 。若有标准状况下5.6L的BC生成,则转移的电子数为 。
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式: 。